製品基本情報
成人気管支喘息
「禁忌を含む使用上の注意」等は製品添付文書をご参照ください。
臨床成績 FEV1
海外第Ⅲ相試験
喘息改善効果(主要評価項目 海外データ)
シングレア®錠10mgは成人の呼吸機能を有意に改善しました(p<0.001、分散分析)1)。
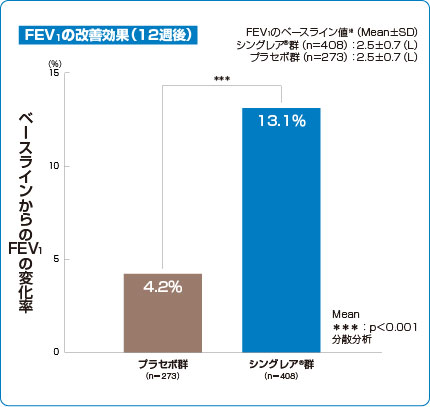
1)より作図
安全性
有害事象で最も多く発現したのは、上気道感染、頭痛、喘息悪化でした。有害事象の発現率は、シングレア®群で上気道感染35.2%、頭痛20.9%、喘息悪化11.7%、プラセボ群で上気道感染31.6%、頭痛17.9%、喘息悪化1.3%でした。また、本試験における有害事象による投与中止例は、シングレア®群で9例(喘息悪化3例、不安感、抑うつ、呼吸困難、胃炎、背部痛、呼吸不全各1例)、プラセボ群で12例(喘息悪化6例、気管支炎2例、抑うつ、顔面浮腫、子宮内膜症、頭痛各1例)でした。その他の投与中止例は、試験継続拒否、プロトコール違反などによるものでした。
【試験】
多施設共同無作為プラセボ対照二重盲検群間比較試験
【対象】
15歳以上の喘息患者 681例
吸入β2刺激薬を頓用、FEV1は予測値の50~85%、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:FEV1の変化率
副次評価項目:日中症状スコア、朝のピークフロー値、喘息増悪頻度、夜間の目覚め日数など
【解析計画】
評価項目におけるシングレア®錠10mgのプラセボに対する優越性について検証した。主要評価項目は、分散分析を用いて解析した。
※ベースライン値:観察期間における平均値
1)Reiss TF et al.Arch Intem Med 1998;158(11):1213-1220.
[利益相反]MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Reiss TF、Seidenberg B、Shingo SはMSD社員。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
喘息改善効果(主要評価項目 海外データ)
シングレア®錠10mgは成人の呼吸機能を有意に改善しました(p<0.001、分散分析)1)。

1)より作図
安全性
有害事象で最も多く発現したのは、上気道感染、頭痛、喘息悪化でした。有害事象の発現率は、シングレア®群で上気道感染35.2%、頭痛20.9%、喘息悪化11.7%、プラセボ群で上気道感染31.6%、頭痛17.9%、喘息悪化1.3%でした。また、本試験における有害事象による投与中止例は、シングレア®群で9例(喘息悪化3例、不安感、抑うつ、呼吸困難、胃炎、背部痛、呼吸不全各1例)、プラセボ群で12例(喘息悪化6例、気管支炎2例、抑うつ、顔面浮腫、子宮内膜症、頭痛各1例)でした。その他の投与中止例は、試験継続拒否、プロトコール違反などによるものでした。
【試験】
多施設共同無作為プラセボ対照二重盲検群間比較試験
【対象】
15歳以上の喘息患者 681例
吸入β2刺激薬を頓用、FEV1は予測値の50~85%、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:FEV1の変化率
副次評価項目:日中症状スコア、朝のピークフロー値、喘息増悪頻度、夜間の目覚め日数など
【解析計画】
評価項目におけるシングレア®錠10mgのプラセボに対する優越性について検証した。主要評価項目は、分散分析を用いて解析した。
※ベースライン値:観察期間における平均値
1)Reiss TF et al.Arch Intem Med 1998;158(11):1213-1220.
[利益相反]MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Reiss TF、Seidenberg B、Shingo SはMSD社員。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
臨床成績 夜間の目覚め
海外第Ⅲ相試験
夜間に目覚めた日数の減少(参考情報 副次評価項目 海外データ)
シングレア®錠10mgは夜間に目覚めた日数を減少させました1)。
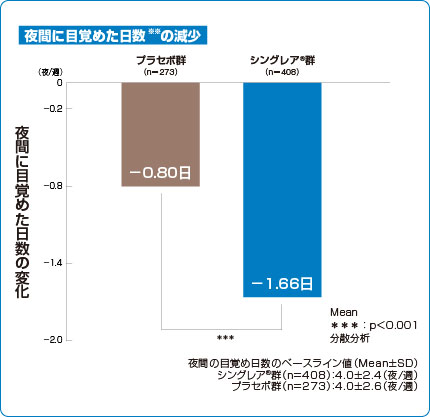
1)より作図
安全性
有害事象で最も多く発現したのは、上気道感染、頭痛、喘息悪化でした。有害事象の発現率は、シングレア®群で上気道感染35.2%、頭痛20.9%、喘息悪化11.7%、プラセボ群で上気道感染31.6%、頭痛17.9%、喘息悪化1.3%でした。また、本試験における有害事象による投与中止例は、シングレア®群で9例(喘息悪化3例、不安感、抑うつ、呼吸困難、胃炎、背部痛、呼吸不全各1例)、プラセボ群で12例(喘息悪化6例、気管支炎2例、抑うつ、顔面浮腫、子宮内膜症、頭痛各1例)でした。その他の投与中止例は、試験継続拒否、プロトコール違反などによるものでした。
【試験】
多施設共同無作為プラセボ対照二重盲検群間比較試験
【対象】
15歳以上の喘息患者 681例
吸入β2刺激薬を頓用、FEV1は予測値の50~85%、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:FEV1の変化率
副次評価項目:日中症状スコア、朝のピークフロー値、喘息増悪頻度、夜間の目覚め日数など
【解析計画】
評価項目におけるシングレア®錠10mgのプラセボに対する優越性について検証した。副次評価項目は、分散分析を用いて解析した。
※※夜間の目覚め:喘息症状による目覚め
1)Reiss TF et al.Arch Intem Med 1998;158(11):1213-1220.
[利益相反]MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Reiss TF、Seidenberg B、Shingo SはMSD社員。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
夜間に目覚めた日数の減少(参考情報 副次評価項目 海外データ)
シングレア®錠10mgは夜間に目覚めた日数を減少させました1)。

1)より作図
安全性
有害事象で最も多く発現したのは、上気道感染、頭痛、喘息悪化でした。有害事象の発現率は、シングレア®群で上気道感染35.2%、頭痛20.9%、喘息悪化11.7%、プラセボ群で上気道感染31.6%、頭痛17.9%、喘息悪化1.3%でした。また、本試験における有害事象による投与中止例は、シングレア®群で9例(喘息悪化3例、不安感、抑うつ、呼吸困難、胃炎、背部痛、呼吸不全各1例)、プラセボ群で12例(喘息悪化6例、気管支炎2例、抑うつ、顔面浮腫、子宮内膜症、頭痛各1例)でした。その他の投与中止例は、試験継続拒否、プロトコール違反などによるものでした。
【試験】
多施設共同無作為プラセボ対照二重盲検群間比較試験
【対象】
15歳以上の喘息患者 681例
吸入β2刺激薬を頓用、FEV1は予測値の50~85%、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:FEV1の変化率
副次評価項目:日中症状スコア、朝のピークフロー値、喘息増悪頻度、夜間の目覚め日数など
【解析計画】
評価項目におけるシングレア®錠10mgのプラセボに対する優越性について検証した。副次評価項目は、分散分析を用いて解析した。
※※夜間の目覚め:喘息症状による目覚め
1)Reiss TF et al.Arch Intem Med 1998;158(11):1213-1220.
[利益相反]MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Reiss TF、Seidenberg B、Shingo SはMSD社員。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
臨床成績 長期試験
国内長期投与試験
最終全般改善度(有効性主要評価項目)
シングレア®錠10mgは、24週で42.1%、52週で43.4%の有効率※を示しました2)。
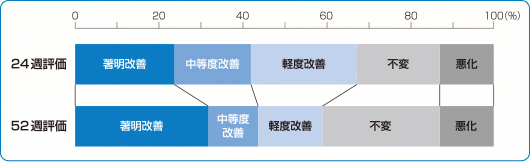
2)より
※最終全般改善度として中等度改善以上
長期(52週)症状改善効果(有効性副次評価項目)
シングレア®錠10mgは長期(52週)にわたり症状点数※※を改善しました2)。
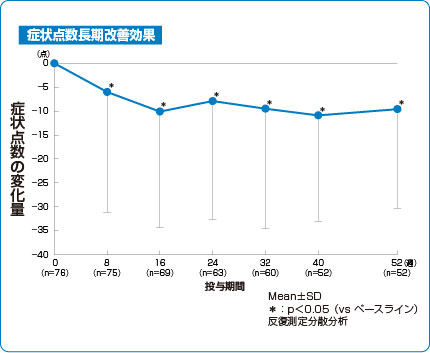
2)より
長期(52週)概括安全度(安全性主要評価項目)
副作用は8例/92例(8.7%、16件)に認められ、頭痛、下痢、軟便各2件、無気力、腹痛、胃痛、嘔気、吐き気、胸やけ、嘔吐、胃不快感、倦怠感、手足の腫脹各1件でした。
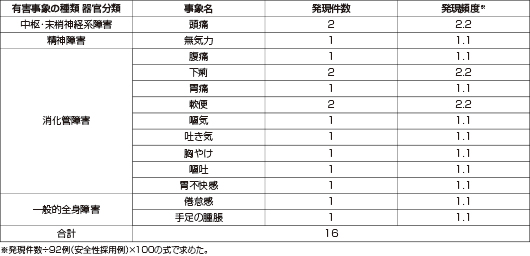
2)より
【試験】
多施設共同オープン試験
【対象】
16歳以上の軽症~中等症の喘息患者 94例
【方法】

【評価項目】
主要評価項目:最終全般改善度、概括安全度、有用度
副次評価項目:時期別全般改善度、患者の印象、起床時および就寝前ピークフロー値、臨床症状(症状点数)、併用薬の使用状況(治療点数)、症状点数と治療点数の総合状況(喘息点数)、日常生活点数、夜間睡眠点数、一般肺機能検査、ラ音および末梢血中好酸球
【解析計画】
シングレア®錠10mgの有効性、安全性及び有用度を検証した。評価項目の変化量は、反復測定分散分析を用いて解析した。
※※症状点数(宮本昭正 他. アレルギー 1994;43(1):71-80. より)
1日を朝、昼、夕、夜の4回に分け、その時間における喘息症状の程度をそれぞれ7段階(A、B、C、D1、D2、E1、E2)で評価
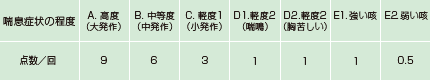
※※※基礎治療薬:観察期間以前より使用中の試験除外基準に抵触しない治療薬
2)宮本昭正 他. 臨床医薬 2001;17(4):577-595.
重要な基本的注意(抜粋)
(8)本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
最終全般改善度(有効性主要評価項目)
シングレア®錠10mgは、24週で42.1%、52週で43.4%の有効率※を示しました2)。

2)より
※最終全般改善度として中等度改善以上
長期(52週)症状改善効果(有効性副次評価項目)
シングレア®錠10mgは長期(52週)にわたり症状点数※※を改善しました2)。

2)より
長期(52週)概括安全度(安全性主要評価項目)
副作用は8例/92例(8.7%、16件)に認められ、頭痛、下痢、軟便各2件、無気力、腹痛、胃痛、嘔気、吐き気、胸やけ、嘔吐、胃不快感、倦怠感、手足の腫脹各1件でした。

2)より
【試験】
多施設共同オープン試験
【対象】
16歳以上の軽症~中等症の喘息患者 94例
【方法】

【評価項目】
主要評価項目:最終全般改善度、概括安全度、有用度
副次評価項目:時期別全般改善度、患者の印象、起床時および就寝前ピークフロー値、臨床症状(症状点数)、併用薬の使用状況(治療点数)、症状点数と治療点数の総合状況(喘息点数)、日常生活点数、夜間睡眠点数、一般肺機能検査、ラ音および末梢血中好酸球
【解析計画】
シングレア®錠10mgの有効性、安全性及び有用度を検証した。評価項目の変化量は、反復測定分散分析を用いて解析した。
※※症状点数(宮本昭正 他. アレルギー 1994;43(1):71-80. より)
1日を朝、昼、夕、夜の4回に分け、その時間における喘息症状の程度をそれぞれ7段階(A、B、C、D1、D2、E1、E2)で評価

※※※基礎治療薬:観察期間以前より使用中の試験除外基準に抵触しない治療薬
2)宮本昭正 他. 臨床医薬 2001;17(4):577-595.
重要な基本的注意(抜粋)
(8)本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
臨床成績 気道炎症改善効果
気道炎症改善効果(主要評価項目)
シングレア®錠10mgは気道炎症の指標である喀痰中の好酸球数を減少させました3)。
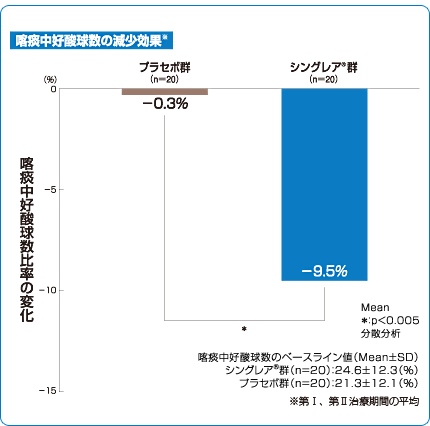
安全性
有害事象は29例中13例に認められ、最も多く発現したのは、かぜ症候群でした。
【試験】
無作為プラセボ対照二重盲検クロスオーバー比較試験
【対象】
平均36.8歳の軽症~中等症の喘息患者 29例
喀痰中の好酸球数比率が10%を超え、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】
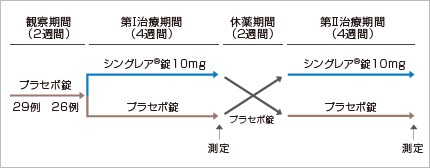
【評価項目】
主要評価項目:喀痰中好酸球数比率の推移
副次評価項目:ヒスタミン試験におけるPC20の推移、一般肺機能、PEF/症状の推移、安全性
【解析計画】
評価項目におけるシングレア®錠10mgの有効性、安全性を検討した。主要評価項目は、分散分析を用いて解析した。
3)Minoguchi K et al. Chest 2002;121(3):732-738.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。)が本研究に資金提供。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
シングレア®錠10mgは気道炎症の指標である喀痰中の好酸球数を減少させました3)。

安全性
有害事象は29例中13例に認められ、最も多く発現したのは、かぜ症候群でした。
【試験】
無作為プラセボ対照二重盲検クロスオーバー比較試験
【対象】
平均36.8歳の軽症~中等症の喘息患者 29例
喀痰中の好酸球数比率が10%を超え、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:喀痰中好酸球数比率の推移
副次評価項目:ヒスタミン試験におけるPC20の推移、一般肺機能、PEF/症状の推移、安全性
【解析計画】
評価項目におけるシングレア®錠10mgの有効性、安全性を検討した。主要評価項目は、分散分析を用いて解析した。
3)Minoguchi K et al. Chest 2002;121(3):732-738.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。)が本研究に資金提供。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
成人喘息 安全性
自他覚的副作用(承認時)
国内で実施された臨床試験において、523例中46例(8.8%)に66件の副作用が認められました。
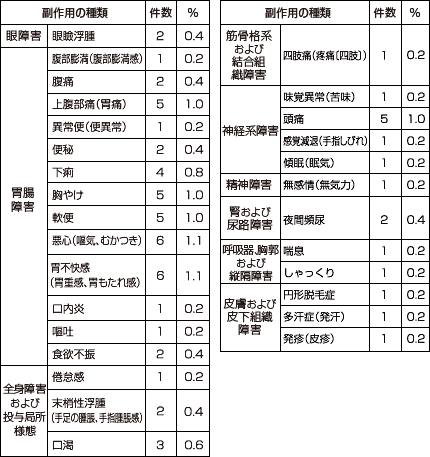
主な副作用は下痢*9件(1.7%)、腹痛*7件(1.3%)、嘔気*6件(1.1%)、胸やけ5件(1.0%)、頭痛5件(1.0%)等(承認時)であり、重大な副作用としてアナフィラキシー(頻度不明)、血管浮腫(頻度不明)、劇症肝炎(頻度不明)、肝炎(頻度不明)、肝機能障害(0.01%)、黄疸(頻度不明)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(0.01%)、血小板減少(頻度不明)が報告されています。
*下痢:軟便を含む、腹痛:胃痛を含む、嘔気:悪心、むかつきを含む
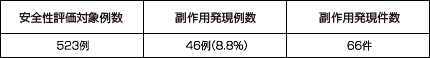
(承認時社内集計)
臨床検査値異常(承認時)
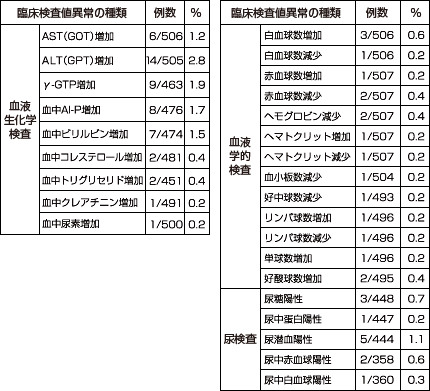
臨床検査値の異常変動は、507例中49例80件に認められ、主なものはALT(GPT)上昇(505例中14件)、γ-GTP上昇(463例中9件)、Al-P上昇(476例中8件)等でした。(承認時)

(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
①長期使用に関する調査
気管支喘息の患者を対象として観察期間1年(53週)以上で、使用実態下における長期使用例での有効性及び安全性の検討を目的として調査を実施しました。安全性評価対象症例1,262例において、24例に副作用が認められ、副作用発現症例率は1.9%でした。重篤な副作用は歩行障害1件であり、回復しました。
本剤が53週以上長期投与された患者における副作用発現率は0.1%(1/701例)で、投与期間に伴う発現率の増加は認められませんでした。
②その他の特定使用成績調査(高齢者・腎機能障害患者・肝機能障害患者)
気管支喘息の患者を対象として観察期間12週間以上で、高齢者・腎機能障害患者・肝機能障害患者の使用実態下における有効性及び安全性の検討を目的として調査を実施しました。安全性評価対象症例2,629例において、70例に副作用が認められ、副作用発現症例率は2.7%でした。重篤な副作用は発熱、肝機能異常、糖尿病、食欲不振及び動悸の各1件であり、転帰は回復又は軽快4件、不明(糖尿病)1件でした。
また、各当該患者における副作用発現症例率は、高齢者3.2%(38/1,204例)、腎機能障害を有する患者5.4%(7/130例)及び肝機能障害を有する患者3.0%(8/264例)であり, 各々非高齢者2.2%(32/1,425例)、腎機能障害を有しない患者2.5%(60/2,358例)及び肝機能障害を有しない患者2.7%(59/2,224例)に比較して、副作用発現症例率に大きな違いは認められませんでした。
上記①②より、国内で実施された特定使用成績調査における安全性評価対象3,891例中94例(2.4%)に116件(臨床検査値異常を含む)の副作用が認められ、主な副作用は、肝機能異常、LDH増加、Al-P上昇、発疹各8件(0.2%)、そう痒症6件(0.2%)でした。(再審査終了時)
重要な基本的注意(抜粋)
(7)本剤を含めロイコトリエン拮抗剤使用時に好酸球性多発血管炎性肉芽腫症様の血管炎を生じたとの報告がある。これらの症状は、おおむね経口ステロイド剤の減量・中止時に生じている。本剤使用時は、特に好酸球数の推移及びしびれ、四肢脱力、発熱、関節痛、肺の浸潤影等の血管炎症状に注意すること。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
国内で実施された臨床試験において、523例中46例(8.8%)に66件の副作用が認められました。
主な副作用は下痢*9件(1.7%)、腹痛*7件(1.3%)、嘔気*6件(1.1%)、胸やけ5件(1.0%)、頭痛5件(1.0%)等(承認時)であり、重大な副作用としてアナフィラキシー(頻度不明)、血管浮腫(頻度不明)、劇症肝炎(頻度不明)、肝炎(頻度不明)、肝機能障害(0.01%)、黄疸(頻度不明)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(0.01%)、血小板減少(頻度不明)が報告されています。
*下痢:軟便を含む、腹痛:胃痛を含む、嘔気:悪心、むかつきを含む
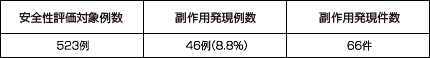

(承認時社内集計)
臨床検査値異常(承認時)
臨床検査値の異常変動は、507例中49例80件に認められ、主なものはALT(GPT)上昇(505例中14件)、γ-GTP上昇(463例中9件)、Al-P上昇(476例中8件)等でした。(承認時)


(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
①長期使用に関する調査
気管支喘息の患者を対象として観察期間1年(53週)以上で、使用実態下における長期使用例での有効性及び安全性の検討を目的として調査を実施しました。安全性評価対象症例1,262例において、24例に副作用が認められ、副作用発現症例率は1.9%でした。重篤な副作用は歩行障害1件であり、回復しました。
本剤が53週以上長期投与された患者における副作用発現率は0.1%(1/701例)で、投与期間に伴う発現率の増加は認められませんでした。
②その他の特定使用成績調査(高齢者・腎機能障害患者・肝機能障害患者)
気管支喘息の患者を対象として観察期間12週間以上で、高齢者・腎機能障害患者・肝機能障害患者の使用実態下における有効性及び安全性の検討を目的として調査を実施しました。安全性評価対象症例2,629例において、70例に副作用が認められ、副作用発現症例率は2.7%でした。重篤な副作用は発熱、肝機能異常、糖尿病、食欲不振及び動悸の各1件であり、転帰は回復又は軽快4件、不明(糖尿病)1件でした。
また、各当該患者における副作用発現症例率は、高齢者3.2%(38/1,204例)、腎機能障害を有する患者5.4%(7/130例)及び肝機能障害を有する患者3.0%(8/264例)であり, 各々非高齢者2.2%(32/1,425例)、腎機能障害を有しない患者2.5%(60/2,358例)及び肝機能障害を有しない患者2.7%(59/2,224例)に比較して、副作用発現症例率に大きな違いは認められませんでした。
上記①②より、国内で実施された特定使用成績調査における安全性評価対象3,891例中94例(2.4%)に116件(臨床検査値異常を含む)の副作用が認められ、主な副作用は、肝機能異常、LDH増加、Al-P上昇、発疹各8件(0.2%)、そう痒症6件(0.2%)でした。(再審査終了時)
重要な基本的注意(抜粋)
(7)本剤を含めロイコトリエン拮抗剤使用時に好酸球性多発血管炎性肉芽腫症様の血管炎を生じたとの報告がある。これらの症状は、おおむね経口ステロイド剤の減量・中止時に生じている。本剤使用時は、特に好酸球数の推移及びしびれ、四肢脱力、発熱、関節痛、肺の浸潤影等の血管炎症状に注意すること。
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。