臨床成績
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
1.国内第Ⅲ相臨床試験
―気管支喘息を対象としたアズマネックス®とフルチカゾンプロピオン酸エステルDPIとの非盲検、非劣性比較試験―
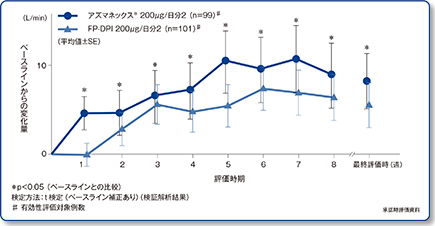
起床時PEF値のベースラインからの平均変化量の推移(主要評価項目、検証解析結果)
アズマネックス®は、投与第1週目から、ベースラインに比べて起床時のPEF値を4.7L/min有意に改善[p<0.05、t検定(ベースライン補正あり)]しました。また、起床時PEF(最終評価時)のベースラインからの平均変化量(投与前値調整済)は、アズマネックス®群で8.2L/min、フルチカゾン群で5.5L/minとなり、その差の95%CIは-6.05~11.34でした。下限値が非劣性限界値(-Δ=-20L/min)を上回ったことから、アズマネックス®群のフルチカゾン群に対する非劣性が検証されました(検証解析結果)。
安全性
副作用は、アズマネックスⓇ群で99例中28例(28.3%)、FP-DPI群で102例中23例(22.5%)に認められました。主な副作用は、アズマネックスⓇ群でオステオカルシン減少7例(7.1%)、嗄声5例(5.1%)、血中LDH増加3例(3.0%)など、FP-DPI群で嗄声6例(5.9%)、咽喉頭疼痛5例(4.9%)、口腔カンジダ症4例(3.9%)などでした。重篤な副作用はアズマネックスⓇ群で扁桃周囲炎1例に認められ、投与中止に至りました。
目的:試験開始前に吸入ステロイド薬を使用していた気管支喘息患者を対象として、アズマネックス®またはフルチカゾンプロピオン酸エステル吸入用散剤(FP-DPI)を8週間経口吸入投与し、アズマネックス®の有効性がFP-DPIに比して劣らないことを検証すること(実薬対照非劣性試験)。
対象:ベクロメタゾンプロピオン酸エステル定量噴霧式吸入剤(BDP-CFC※)400μg/日を4週間以上使用している中等症の気管支喘息患者200例
方法:投与前にBDP-CFC400μg/日を4週間以上使用しコントロールした上(第1投与期)、アズマネックス®200μg/日、またはFP-DPI 200μg/日をそれぞれ1日2回に分け、8週間投与した(第2投与期)。(非盲検試験)
それぞれの投与終了時点および各測定時点における起床時PEF値を測定し、ベースライン(第2投与期開始前1週間)からの変化量を求めた。
主要評価項目:起床時PEF値のベースラインからの変化量
副次評価項目:夜のPEF値とFEV1のベースラインからの変化量
評価方法:投与終了時点および各測定時点における起床時PEF 値を測定し、ベースライン(第2 投与
期開始前1週間)からの変化量を求めた。
解析計画:下限値が非劣性限界値(-△=-20L/min)を上回り、アズマネックス®のFP-DPIに対する非
劣性を、t検定(ベースライン補正あり)により検証した。
※国内販売中止
承認時評価資料
5. 効能又は効果に関連する注意(抜粋)
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態
又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
2.軽症喘息患者に対する効果
―アズマネックス®第Ⅲ相臨床試験(非ステロイド治療患者試験)―
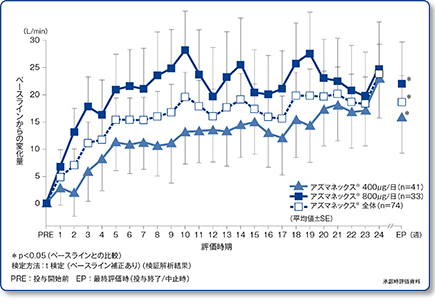
起床時平均PEF値の推移(主要評価項目)
吸入ステロイド薬投与歴のない軽症喘息患者においても、アズマネックス®投与により、起床時PEF値のベースラインからの有意な上昇が認められました[29.8L/min(95%信頼区間:10.5~49.1)、p<0.05、t検定(ベースライン補正あり)]。
安全性
副作用は、20例中8例(40.0%)に認められました。主な副作用は嗄声3件(15.0%)、口渇、咽頭カンジダ症、血中コルチゾール減少、オステオカルシン減少、血中Al-P 増加、味覚減退、咳嗽、咽喉頭疼痛各1件(5.0%)でした。重篤な副作用、投与中止に至った副作用は認められませんでした。
目的:吸入ステロイド薬を使用していない気管支喘息患者(主として軽症間欠型および軽症持続型)を対象として、アズマネックス®を8週間経口吸入投与し、有効性および安全性を評価すること。
対象:吸入ステロイド薬を使用していない、軽症(主として軽症間欠型および軽症持続型)気管支喘息患者20例
方法:アズマネックス®200μg/日を1日2 回に分けて8週間投与した。(オープンラベル試験)
主要評価項目:起床時PEF値のベースラインからの変化量
副次評価項目:夜のPEF値とFEV1のベースラインからの変化量
評価方法:起床時PEF値のベースラインからの推移を検討した。
解析計画:アズマネックス®を8週間経口吸入投与し、有効性と安全性について、t検定(ベースライン補正あり)により検証した。
承認時評価資料
5. 効能又は効果に関連する注意(抜粋)
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態
又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
3.重症喘息患者に対する効果
―重症気管支喘息を対象としたアズマネックス®高用量投与試験―
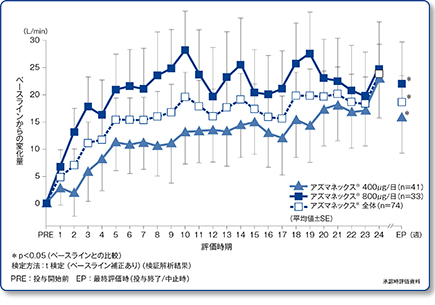
起床時PEF値平均変化量の推移(主要評価項目)
ベクロメタゾンプロピオン酸エステル定量噴霧式吸入剤(BDP-CFC※)またはフルチカゾンプロピオン酸エステル吸入用散剤(FP-DPI)からアズマネックス®への切り替えにより、起床時PEF値は両群とも有意な改善を示しました[400μg群:16.1L/min(95%信頼区間:2.89~29.36)、800μg群:22.0L/min(95%信頼区間:6.55~37.39)、いずれもp<0.05、t検定(ベースライン補正あり)]。
安全性
副作用は、75例中33例(44.0%)に認められました。主な副作用は、血中コルチゾール減少12例(16.0%)、口腔カンジダ症11例(14.7%)、オステオカルシン減少6 例(8.0%)などでした。重篤な副作用、投与中止に至った副作用は認められませんでした。
目的:重症気管支喘息患者を対象としてアズマネックス®を12週間以上24週間まで経口吸入した時の有効性および安全性を検討すること。
対象:試験開始4週間以上前からBDP-CFC800~1,600μg/日またはFP-DPI400~800μg/日を使用していた重症の
気管支喘息患者75例
方法:対象のうち、BDP-CFC 800~1,200μg/日またはFP-DPI400~600μg/日を使用していた患者はアズマネックス®400μg/日群に、またBDP-CFC1,200~1,600μg/日またはFP-DPI600~800μg/日を使用していた患者はアズマネックス®800μg/日群に割付け、それぞれ1日2回に分けて12~14週間投与した。ただし、400μg/日群は2、4、8週目に800μg/日への増量を可とした。また両群とも12週以降に用量を見直し、400μg/日とするか、800μg/日とするかを選択した。(多施設共同、非盲検試験)
主要評価項目:起床時PEF値のベースラインからの変化量
副次評価項目:夜のPEF値とFEV1のベースラインからの変化量
評価方法:起床時PEF 値のベースラインからの変化量の推移を検討した。
解析計画:アズマネックス®を12~24週間経口吸入投与し、t検定(ベースライン補正あり)により評価項目の変動を検証した。
※国内販売中止
承認時評価資料
5. 効能又は効果に関連する注意(抜粋)
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態
又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
8. 重要な基本的注意(抜粋)
8.4 全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用
(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を
含む)が発現する可能性があるので、吸入ステロイド剤の投与量は患者毎に喘息をコントロールできる最少用量に
調節すること。
国内臨床試験においては本剤の1日最大用量(800 μg/日)を長期投与した場合の安全性についての情報は
限られており、また、日本人に本剤800 μg/日を反復投与したときのCmax、AUCは外国人と比べて高かったとの
報告があることから、本剤の1日最大用量投与時には患者の状態を十分に観察しながら投与を行うこと。
特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息症状を
観察しながら徐々に減量するなど適切な処置を行うこと。[7.1、16.1.2参照]
9. 特定の背景を有する患者に関する注意(抜粋)
9.1 合併症・既往歴等のある患者
9.1.4 長期又は大量の全身性ステロイド療法を受けている患者、あるいは全身性ステロイド剤から吸入ステロイド剤に切り替えた患者
全身性ステロイド剤の減量中並びに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に
注意を払うこと。また、必要があれば一時的に全身性ステロイド剤の増量を行い、患者の全身状態を観察しながら、
症状の改善に伴い徐々に減量していくこと。これらの患者では副腎皮質機能不全となっていることが考えられる。
4.長期試験
―吸入ステロイド薬を使用していた気管支喘息患者を対象としたアズマネックス®の長期投与試験―
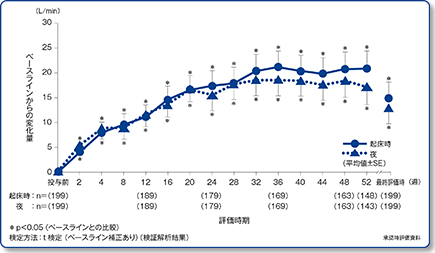
長期間投与における起床時のPEF値(主要評価項目)および夜のPEF値(副次評価項目)の推移
起床時PEF値は、アズマネックス®投与後52週までの期間を通じてベースラインから有意に上昇[最終評価時の平均変化量:15.0L/min(95%両側信頼区間:7.9~22.0)、p<0.05、t検定(ベースライン補正あり)]した。
夜のPEF値は以下の通りであった。
安全性
副作用は、203例中83例(40.9%)に認められました。主な副作用は、口腔カンジダ症25例(12.3%)、発声障害16例(7.9%)、血中コルチゾール減少12例(5.9%)、オステオカルシン減少11例(5.4%)、白内障7例(3.4%)などでした。重篤な副作用は乳癌1例(0.5%)に認められ、投与中止に至りました。
目的:試験開始前に吸入ステロイド薬を使用していた気管支喘息患者を対象として、アズマネックス®を52週間経口吸入投与した時の安全性を主に、有効性も検討すること。
対象:吸入ステロイド薬でコントロールされていた気管支喘息患者199 例
方法:アズマネックス®400μg/日を52週間投与した。また投与12週以降に用量見直しを行うこととした。
(多施設共同、非盲検試験)
主要評価項目:起床時PEF値のベースラインからの変化量
副次評価項目:夜のPEF値とFEV1のベースラインからの変化量
評価方法:アズマネックス®投与1~52週後および最終評価時の起床時および夜のPEF値のベースラインからの変化量を、
経時的に検討した。
解析計画:アズマネックス®を52週間経口吸入投与し、評価項目の変動をt検定(ベースライン補正あり)により検討した。
承認時評価資料
5. 効能又は効果に関連する注意(抜粋)
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態
又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
8. 重要な基本的注意(抜粋)
8.4 全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用
(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を
含む)が発現する可能性があるので、吸入ステロイド剤の投与量は患者毎に喘息をコントロールできる最少用量に
調節すること。
国内臨床試験においては本剤の1日最大用量(800 μg/日)を長期投与した場合の安全性についての情報は
限られており、また、日本人に本剤800 μg/日を反復投与したときのCmax、AUCは外国人と比べて高かったとの
報告があることから、本剤の1日最大用量投与時には患者の状態を十分に観察しながら投与を行うこと。
特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息症状を
観察しながら徐々に減量するなど適切な処置を行うこと。[7.1、16.1.2参照]
5.高齢喘息患者に対する効果
―高齢者の喘息患者を対象としたアズマネックス®の臨床薬理試験―
– –
血漿中MF濃度のCmax、AUC0-t(主要評価項目)
血漿中MF 濃度が3 時点以上の連続したポイントで定量可能であった患者は12 例中1例であり、3例が全測定時点で定量下限未満(<50pg/mL)であったことから、薬物動態パラメータは算出できませんでした。
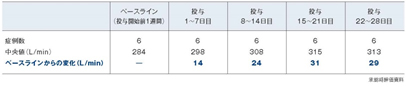
起床時PEF値平均変化量の推移(副次評価項目)
アズマネックス® 投与後の高齢喘息患者群のベースラインからの起床時PEF値平均変化量は、投与1~7日目では14L/min、投与22~28日目では29L/minでした。
安全性
副作用は、非高齢者群6例中1例に嗄声が認められました。重篤な副作用、投与中止に至った副作用は認められませんでした。
目的:高齢喘息患者を対象に、アズマネックス®を28日間反復吸入投与した時の薬物動態を非高齢喘息患者と比較するとともに有効性および安全性を検討すること。
対象:ベクロメタゾンプロピオン酸エステル定量噴霧式吸入剤(BDP-CFC※)800μg/日まで、またはフルチカゾンプロピオン酸エステル吸入用散剤(FP-DPI)400μg/日までを投与されていた、高齢(65歳以上)および非高齢の気管支喘息患者各6例
方法:高齢者、非高齢者ともに、アズマネックス®400μg/日を1日2回に分けて4 週間投与した。(非盲検試験)
主要評価項目:血漿中MF濃度のCmax、AUC0-t副次評価項目:起床時PEF値の平均変化量
評価方法:起床時PEF値のベースラインからの変化量を、高齢喘息患者群と非高齢喘息患者群で比較した。
※国内販売中止
承認時評価資料
5. 効能又は効果に関連する注意(抜粋)
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態
又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
9. 特定の背景を有する患者に関する注意(抜粋)
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。