製品基本情報
製品基本情報
アレルギー性鼻炎
「禁忌を含む使用上の注意」等は製品添付文書をご参照ください。
臨床成績 総合鼻症状点数
国内第Ⅱ相至適用量設定試験
季節性アレルギー性鼻炎 総合鼻症状点数の改善効果(主要評価項目 検証解析結果)
シングレア®錠はいずれの投与群においても、総合鼻症状(治療期間2週間の平均)において有意な改善を認めました(検証的な解析結果)1)。
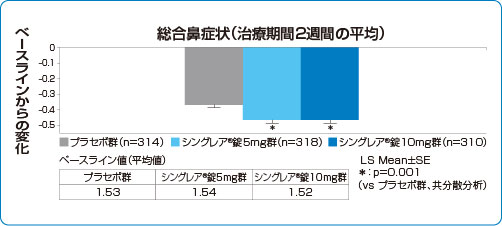
1)より
安全性
副作用の発現率は、シングレア®錠5mg群4.7%(15例/318例)、シングレア®錠10mg群4.2%(13例/310例)、プラセボ群4.1%(13例/315例)でした。主な副作用は、シングレア®錠5mg群で上腹部痛2例など、シングレア®錠10mg群で口渇4例、頭痛、傾眠各3例、便秘2例など、プラセボ群で傾眠4例、便秘3例、口渇、頭痛各2例などでした。
【試験】
多施設共同無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 945例(有効性解析対象942例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価項目】
主要評価項目:総合鼻症状点数(日中および夜間鼻症状点数の平均値)
副次評価項目:日中鼻症状点数、夜間鼻症状点数、総合鼻閉点数(日中および夜間鼻閉点数の平均値)、安全性など
日中鼻症状点数:日中鼻閉点数、鼻汁点数、くしゃみ発作点数※※の平均値
夜間鼻症状点数:夜間鼻閉度、入眠困難度、夜間覚醒度の点数※※の平均値
※※:症状の程度に応じてスコア化(0~4の5段階)
【解析計画】
評価項目におけるシングレア®錠5mg又はシングレア®錠10mgのプラセボに対する優越性について検証した。主要評価項目は、共分散分析を用いて解析した。
1)Okubo K and Baba K. Allergol Int 2008;57(3):247-255.
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
季節性アレルギー性鼻炎 総合鼻症状点数の改善効果(主要評価項目 検証解析結果)
シングレア®錠はいずれの投与群においても、総合鼻症状(治療期間2週間の平均)において有意な改善を認めました(検証的な解析結果)1)。

1)より
安全性
副作用の発現率は、シングレア®錠5mg群4.7%(15例/318例)、シングレア®錠10mg群4.2%(13例/310例)、プラセボ群4.1%(13例/315例)でした。主な副作用は、シングレア®錠5mg群で上腹部痛2例など、シングレア®錠10mg群で口渇4例、頭痛、傾眠各3例、便秘2例など、プラセボ群で傾眠4例、便秘3例、口渇、頭痛各2例などでした。
【試験】
多施設共同無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 945例(有効性解析対象942例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価項目】
主要評価項目:総合鼻症状点数(日中および夜間鼻症状点数の平均値)
副次評価項目:日中鼻症状点数、夜間鼻症状点数、総合鼻閉点数(日中および夜間鼻閉点数の平均値)、安全性など
日中鼻症状点数:日中鼻閉点数、鼻汁点数、くしゃみ発作点数※※の平均値
夜間鼻症状点数:夜間鼻閉度、入眠困難度、夜間覚醒度の点数※※の平均値
※※:症状の程度に応じてスコア化(0~4の5段階)
【解析計画】
評価項目におけるシングレア®錠5mg又はシングレア®錠10mgのプラセボに対する優越性について検証した。主要評価項目は、共分散分析を用いて解析した。
1)Okubo K and Baba K. Allergol Int 2008;57(3):247-255.
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
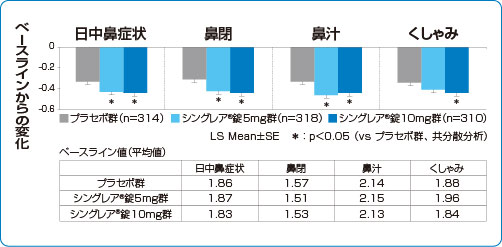
臨床成績 鼻症状改善効果(2週間投与)
国内第Ⅱ相至適用量設定試験
季節性アレルギー性鼻炎 鼻症状改善効果(副次評価項目 検証解析結果)
シングレア®錠10mgは、日中の鼻閉、鼻汁、くしゃみの3大症状において有意な改善を認めました(検証的な解析結果)9)
1)および承認時評価資料より
鼻症状点数の推移(副次評価項目)
シングレア®錠10mgは、投与1日目から総合鼻症状および日中鼻症状を改善しました。1)
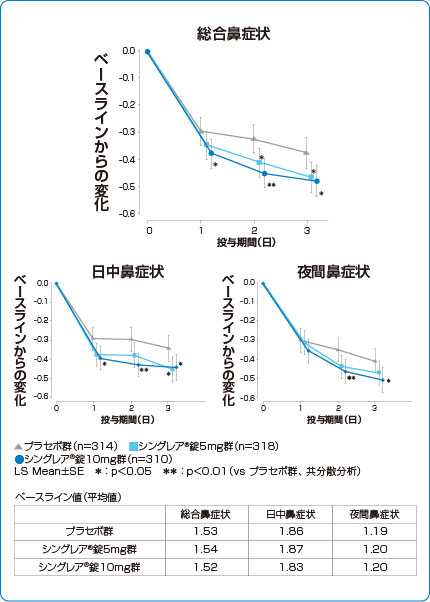
1)より
安全性
副作用の発現率は、シングレア®錠5mg群4.7%(15例/318例)、シングレア®錠10mg群4.2%(13例/310例)、プラセボ群4.1%(13例/315例)でした。主な副作用は、シングレア®錠5mg群で上腹部痛2例など、シングレア®錠10mg群で口渇4例、頭痛、傾眠各3例、便秘2例など、プラセボ群で傾眠4例、便秘3例、口渇、頭痛各2例などでした。
【試験】
多施設共同無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 945例(有効性解析対象942例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価項目】
主要評価項目:総合鼻症状点数(日中および夜間鼻症状点数の平均値)
副次評価項目:日中鼻症状点数、夜間鼻症状点数、総合鼻閉点数(日中および夜間鼻閉点数の平均値)、安全性など
日中鼻症状点数:日中鼻閉点数、鼻汁点数、くしゃみ発作点数※※の平均値
夜間鼻症状点数:夜間鼻閉度、入眠困難度、夜間覚醒度の点数※※の平均値
※※:症状の程度に応じてスコア化(0~4の5段階)
【解析計画】
評価項目におけるシングレア®錠5mg又はシングレア®錠10mgのプラセボに対する優越性について検証した。副次評価項目は、共分散分析を用いて解析した。
1)Okubo K and Baba K. Allergol Int 2008 ; 57(3) : 247-255.
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
季節性アレルギー性鼻炎 鼻症状改善効果(副次評価項目 検証解析結果)
シングレア®錠10mgは、日中の鼻閉、鼻汁、くしゃみの3大症状において有意な改善を認めました(検証的な解析結果)9)
1)および承認時評価資料より

鼻症状点数の推移(副次評価項目)
シングレア®錠10mgは、投与1日目から総合鼻症状および日中鼻症状を改善しました。1)

1)より
安全性
副作用の発現率は、シングレア®錠5mg群4.7%(15例/318例)、シングレア®錠10mg群4.2%(13例/310例)、プラセボ群4.1%(13例/315例)でした。主な副作用は、シングレア®錠5mg群で上腹部痛2例など、シングレア®錠10mg群で口渇4例、頭痛、傾眠各3例、便秘2例など、プラセボ群で傾眠4例、便秘3例、口渇、頭痛各2例などでした。
【試験】
多施設共同無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 945例(有効性解析対象942例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価項目】
主要評価項目:総合鼻症状点数(日中および夜間鼻症状点数の平均値)
副次評価項目:日中鼻症状点数、夜間鼻症状点数、総合鼻閉点数(日中および夜間鼻閉点数の平均値)、安全性など
日中鼻症状点数:日中鼻閉点数、鼻汁点数、くしゃみ発作点数※※の平均値
夜間鼻症状点数:夜間鼻閉度、入眠困難度、夜間覚醒度の点数※※の平均値
※※:症状の程度に応じてスコア化(0~4の5段階)
【解析計画】
評価項目におけるシングレア®錠5mg又はシングレア®錠10mgのプラセボに対する優越性について検証した。副次評価項目は、共分散分析を用いて解析した。
1)Okubo K and Baba K. Allergol Int 2008 ; 57(3) : 247-255.
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
臨床効果 日中および夜間の鼻症状改善効果
国内第Ⅱ相至適用量設定試験
季節性アレルギー性鼻炎 鼻症状改善効果(副次評価項目 検証解析結果)
シングレア®錠10mgは、日中の鼻閉、鼻汁、くしゃみの3大症状において有意な改善を認めました(検証的な解析結果)9)
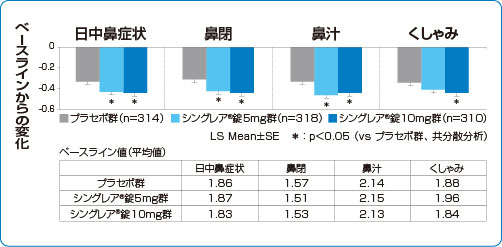
1)および承認時評価資料より
鼻症状点数の推移(副次評価項目)
シングレア®錠10mgは、投与1日目から総合鼻症状および日中鼻症状を改善しました。1)
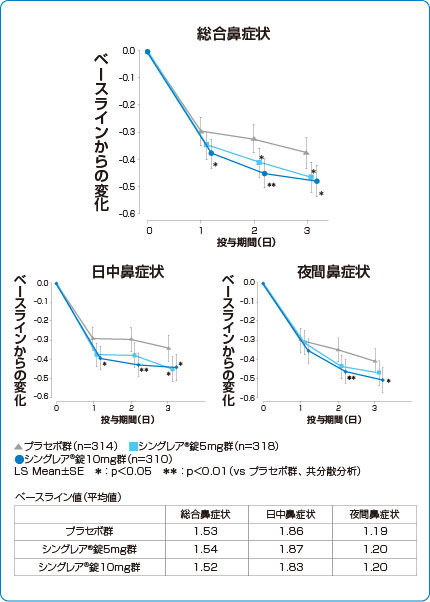
1)より
安全性
副作用の発現率は、シングレア®錠5mg群4.7%(15例/318例)、シングレア®錠10mg群4.2%(13例/310例)、プラセボ群4.1%(13例/315例)でした。主な副作用は、シングレア®錠5mg群で上腹部痛2例など、シングレア®錠10mg群で口渇4例、頭痛、傾眠各3例、便秘2例など、プラセボ群で傾眠4例、便秘3例、口渇、頭痛各2例などでした。
【試験】
多施設共同無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 945例(有効性解析対象942例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価項目】
主要評価項目:総合鼻症状点数(日中および夜間鼻症状点数の平均値)
副次評価項目:日中鼻症状点数、夜間鼻症状点数、総合鼻閉点数(日中および夜間鼻閉点数の平均値)、安全性など
・日中鼻症状点数:日中鼻閉点数、鼻汁点数、くしゃみ発作点数※※の平均値
・夜間鼻症状点数:夜間鼻閉度、入眠困難度、夜間覚醒度の点数※※の平均値
※※:症状の程度に応じてスコア化(0~4の5段階)
【解析計画】
評価項目におけるシングレア®錠5mg又はシングレア®錠10mgのプラセボに対する優越性について検証した。副次評価項目は、共分散分析を用いて解析した。
1)Okubo K and Baba K. Allergol Int 2008 ; 57(3) : 247-255.
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
季節性アレルギー性鼻炎 鼻症状改善効果(副次評価項目 検証解析結果)
シングレア®錠10mgは、日中の鼻閉、鼻汁、くしゃみの3大症状において有意な改善を認めました(検証的な解析結果)9)

1)および承認時評価資料より
鼻症状点数の推移(副次評価項目)
シングレア®錠10mgは、投与1日目から総合鼻症状および日中鼻症状を改善しました。1)

1)より
安全性
副作用の発現率は、シングレア®錠5mg群4.7%(15例/318例)、シングレア®錠10mg群4.2%(13例/310例)、プラセボ群4.1%(13例/315例)でした。主な副作用は、シングレア®錠5mg群で上腹部痛2例など、シングレア®錠10mg群で口渇4例、頭痛、傾眠各3例、便秘2例など、プラセボ群で傾眠4例、便秘3例、口渇、頭痛各2例などでした。
【試験】
多施設共同無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 945例(有効性解析対象942例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価項目】
主要評価項目:総合鼻症状点数(日中および夜間鼻症状点数の平均値)
副次評価項目:日中鼻症状点数、夜間鼻症状点数、総合鼻閉点数(日中および夜間鼻閉点数の平均値)、安全性など
・日中鼻症状点数:日中鼻閉点数、鼻汁点数、くしゃみ発作点数※※の平均値
・夜間鼻症状点数:夜間鼻閉度、入眠困難度、夜間覚醒度の点数※※の平均値
※※:症状の程度に応じてスコア化(0~4の5段階)
【解析計画】
評価項目におけるシングレア®錠5mg又はシングレア®錠10mgのプラセボに対する優越性について検証した。副次評価項目は、共分散分析を用いて解析した。
1)Okubo K and Baba K. Allergol Int 2008 ; 57(3) : 247-255.
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
臨床成績 日中の鼻症状改善効果
海外第Ⅲ相試験
季節性アレルギー性鼻炎 日中の鼻症状改善効果(主要評価項目 検証解析結果 海外データ)
シングレア®錠10mg、ロラタジン錠10mg、および両剤併用で、日中の鼻症状における有意な改善が認められました(検証的な解析結果)3)。
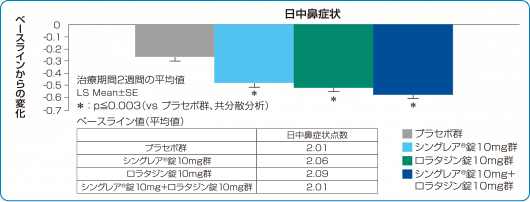
3)より
安全性
副作用の発現率は、シングレア®錠10mg群4.5%(7例/155例)、シングレア®錠10mg+ロラタジン錠10mg群5.3%(16例/302例)、ロラタジン錠10mg群4.0%(12例/301例)、プラセボ群6.0%(9例/149例)でした。主な副作用は、シングレア®錠10mg群で不眠症2例など、シングレア®錠10mg+ロラタジン錠10mg群で無力症、不動性めまい、鼻乾燥、鼻部障害、頭痛、意識レベルの低下各2例など、プラセボ群で頭痛3例、口内乾燥、鼻出血各2例などでした。
【試験】
多施設無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 907例(有効性解析対象 872例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価方法】
主要評価項目:日中の鼻症状点数(鼻閉、鼻汁、鼻内そう痒感、くしゃみ発作点数※※の平均値)
副次評価項目:夜間鼻症状点数(入眠困難度、夜間覚醒度、鼻閉度の点数※※の平均値)、総合鼻症状点数(日中および夜間鼻症状点数の平均値)、日常生活改善度(鼻結膜炎QOL質問票(RQLQ)による評価)など
※※:症状の程度に応じてスコア化(0~3の4段階)
【解析計画】
評価項目におけるシングレア®錠とロラタジン錠併用療法群のシングレア®錠単独療法群に対する優越性を検証した。主要評価項目は、共分散分析を用いて解析した。
3)Nayak AS et al. Ann Allergy Asthma Immunol 2002 ; 88(6) : 592-600.
[利益相反]MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Philip G、Lu S、Malice MP、Reiss TFはMSD米国研究所員。
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
季節性アレルギー性鼻炎 日中の鼻症状改善効果(主要評価項目 検証解析結果 海外データ)
シングレア®錠10mg、ロラタジン錠10mg、および両剤併用で、日中の鼻症状における有意な改善が認められました(検証的な解析結果)3)。

3)より
安全性
副作用の発現率は、シングレア®錠10mg群4.5%(7例/155例)、シングレア®錠10mg+ロラタジン錠10mg群5.3%(16例/302例)、ロラタジン錠10mg群4.0%(12例/301例)、プラセボ群6.0%(9例/149例)でした。主な副作用は、シングレア®錠10mg群で不眠症2例など、シングレア®錠10mg+ロラタジン錠10mg群で無力症、不動性めまい、鼻乾燥、鼻部障害、頭痛、意識レベルの低下各2例など、プラセボ群で頭痛3例、口内乾燥、鼻出血各2例などでした。
【試験】
多施設無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 907例(有効性解析対象 872例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価方法】
主要評価項目:日中の鼻症状点数(鼻閉、鼻汁、鼻内そう痒感、くしゃみ発作点数※※の平均値)
副次評価項目:夜間鼻症状点数(入眠困難度、夜間覚醒度、鼻閉度の点数※※の平均値)、総合鼻症状点数(日中および夜間鼻症状点数の平均値)、日常生活改善度(鼻結膜炎QOL質問票(RQLQ)による評価)など
※※:症状の程度に応じてスコア化(0~3の4段階)
【解析計画】
評価項目におけるシングレア®錠とロラタジン錠併用療法群のシングレア®錠単独療法群に対する優越性を検証した。主要評価項目は、共分散分析を用いて解析した。
3)Nayak AS et al. Ann Allergy Asthma Immunol 2002 ; 88(6) : 592-600.
[利益相反]MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Philip G、Lu S、Malice MP、Reiss TFはMSD米国研究所員。
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
臨床成績 夜間の鼻症状改善効果
海外第Ⅲ相試験
季節性アレルギー性鼻炎 夜間の鼻症状改善効果 (副次評価項目 海外データ)
シングレア®錠10mg、ロラタジン錠10mg、および両剤併用で、夜間の鼻症状を改善しました3)

3)より作図
安全性
副作用の発現率は、シングレア®錠10mg群4.5%(7例/155例)、シングレア®錠10mg+ロラタジン錠10mg群5.3%(16例/302例)、ロラタジン錠10mg群4.0%(12例/301例)、プラセボ群6.0%(9例/149例)でした。主な副作用は、シングレア®錠10mg群で不眠症2例など、シングレア®錠10mg+ロラタジン錠10mg群で無力症、不動性めまい、鼻乾燥、鼻部障害、頭痛、意識レベルの低下各2例など、プラセボ群で頭痛3例、口内乾燥、鼻出血各2例などでした。
【試験】
多施設無作為プラセボ対照二重盲検比較試験
【対象】
季節性アレルギー性鼻炎患者 907例(有効性解析対象 872例)
【方法】
※:いずれも1日1回就寝前に経口投与

【評価方法】
主要評価項目:日中の鼻症状点数(鼻閉、鼻汁、鼻内そう痒感、くしゃみ発作点数※※の平均値)
副次評価項目:夜間鼻症状点数(入眠困難度、夜間覚醒度、鼻閉度の点数※※の平均値)、総合鼻症状点数(日中および夜間鼻症状点数の平均値)、日常生活改善度(鼻結膜炎QOL質問票(RQLQ)による評価)など
※※:症状の程度に応じてスコア化(0~3の4段階)
【解析計画】
評価項目におけるシングレア®錠とロラタジン錠併用療法群のシングレア®錠単独療法群に対する優越性を検証した。副次評価項目は、共分散分析を用いて解析した。
3)Nayak AS et al. Ann Allergy Asthma Immunol 2002 ; 88(6) : 592-600.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Philip G、Lu S、Malice MP、Reiss TFはMSD米国研究所員。
承認時評価資料
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
アレルギー性鼻炎 安全性
自他覚的副作用(承認時)
国内で実施された臨床試験において、1,678例中70例(4.2%)に88件の副作用が認められました。
主な副作用は口渇14件*(0.8%)、傾眠13件(0.8%)、胃不快感9件(0.5%)、頭痛5件(0.3%)、下痢5件(0.3%)、倦怠感5件(0.3%)等でした。1%以上の頻度で認められたものはありませんでした。(承認時)
* 口渇14件の内訳:口内乾燥1件、口渇12件、咽喉乾燥1件

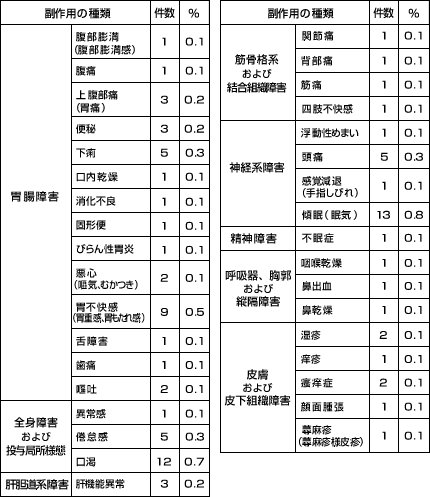
(承認時社内集計)
臨床検査値異常(承認時)
臨床検査値の異常変動は、1,672例中46例51件に認められ、主なものはALT(GPT)上昇(1,672例中9件)、白血球数増加(1,670例中6件)、尿潜血(1,671例中6件)等でした。(承認時)

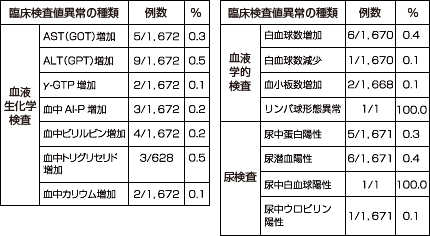
(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
国内で実施された製造販売後調査(使用成績調査及び特定使用成績調査)における安全性評価対象1,365例中9例(0.7%)に9件(臨床検査値異常を含む)の副作用が認められ、主な副作用は、傾眠2件(0.1%)、全身性そう痒症2件(0.1%)でした。(再審査終了時)
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
国内で実施された臨床試験において、1,678例中70例(4.2%)に88件の副作用が認められました。
主な副作用は口渇14件*(0.8%)、傾眠13件(0.8%)、胃不快感9件(0.5%)、頭痛5件(0.3%)、下痢5件(0.3%)、倦怠感5件(0.3%)等でした。1%以上の頻度で認められたものはありませんでした。(承認時)
* 口渇14件の内訳:口内乾燥1件、口渇12件、咽喉乾燥1件


(承認時社内集計)
臨床検査値異常(承認時)
臨床検査値の異常変動は、1,672例中46例51件に認められ、主なものはALT(GPT)上昇(1,672例中9件)、白血球数増加(1,670例中6件)、尿潜血(1,671例中6件)等でした。(承認時)


(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
国内で実施された製造販売後調査(使用成績調査及び特定使用成績調査)における安全性評価対象1,365例中9例(0.7%)に9件(臨床検査値異常を含む)の副作用が認められ、主な副作用は、傾眠2件(0.1%)、全身性そう痒症2件(0.1%)でした。(再審査終了時)
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
