製品基本情報
【参考情報】 性ホルモン結合蛋白とテストステロンに及ぼす影響
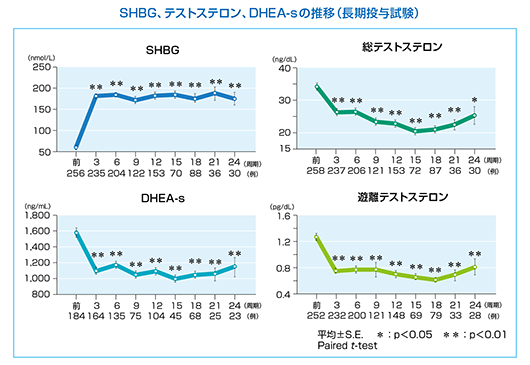
SHBG、テストステロン、DHEA-s
マーベロン®投与により、性ホルモン結合蛋白(SHBG)の有意な上昇が認められた。また、総テストステロン、硫酸ジヒドロエピアンドロステロン(DHEA-s)、及び遊離テストステロンに有意な減少が認められた。
安全性
主な副作用は嘔気117例(12.29%)、乳房痛83例(8.72%)、頭痛57例(5.99%)等であった。投与中止に至った副作用は76例104件で認められ、主な投与中止例は嘔気19例、不正出血15例、倦怠感8例等であった。
目 的 :マーベロン®21の長期投与による避妊効果ならびに安全性、及びマーベロン®28の避妊効果・安全性ならびに実用性を検討する目的で臨床試験を行った。
対 象 :正常な月経周期を有する20歳以上40歳未満の妊娠可能な女性933例。
投与方法:第1周期目は月経の第1日目より本剤1錠を就寝前に21日間連続経口投与、第2周期目からは消退出血の有無に拘わらず7日間の休薬期間の後、8日目より同様に21日間連続経口投与とし、24周期を目標に可能な限り長期間実施した。
評価項目・判定基準:服用日誌、問診ならびに各検査の結果をもとに、避妊効果、安全性、有用性について主治医が判定した。
解析計画:世話人・幹事会において除外規定抵触例等の問題症例、ならびに集計基準等のデータの取扱いについて検討を行い、集計対象例を決定した。避妊効果ならびに周期調節性の集計に関しては、あらかじめ決めた取扱い基準に従って実施した。
承認時評価資料 [水野正彦 他. 産科と婦人科 1990 ; 57(12) : 2507-2532.]
製剤提供はMSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた)が行った
