臨床成績
臨床成績
プロペシア®錠 臨床成績<国内データ (3年)>
1)社内資料:国内第Ⅱ/Ⅲ相二重盲検比較試験(承認時評価資料)
2)Kawashima M et al. Eur J Dermatol 2004; 14(4): 247-254.
【利益相反】本試験は万有製薬(現MSD株式会社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた))の資金援助を受け、著者のうち3名は同社の社員である。
3)社内資料:国内第Ⅱ/Ⅲ相2年間延長オープン試験(承認時評価資料)
安全性(主要評価項目)
プロペシア®錠1mgによるオープン試験に移行した374例における2年間の臨床検査値異常変動を含む副作用発現は4例7件(1.1%)で、二重盲検比較試験で1mgを投与した124例中2例に2件(発熱1例、乳腺症1例)、プラセボを投与した122例中2例に5件(1例に大腸ポリープ及び胃潰瘍、他の1例に貧毛症、尿酸高値、ALT増加)であり、0.2mgを投与した128例には副作用はみられませんでした。
また、オープン試験では、性機能に関する副作用は認められませんでした。
なお、3年間の投与を通じて、死亡、重篤な副作用は認められず、副作用による投与中止例は1mgを投与した2例(発熱1例、乳腺症1例)でした。
改善効果(副次評価項目:写真評価):プロペシア®錠1mg 3年間投与
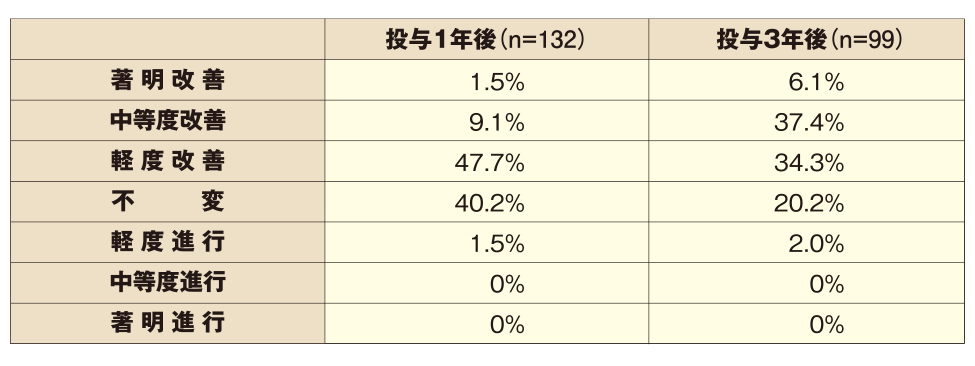
■頭頂部写真
■前頭部写真
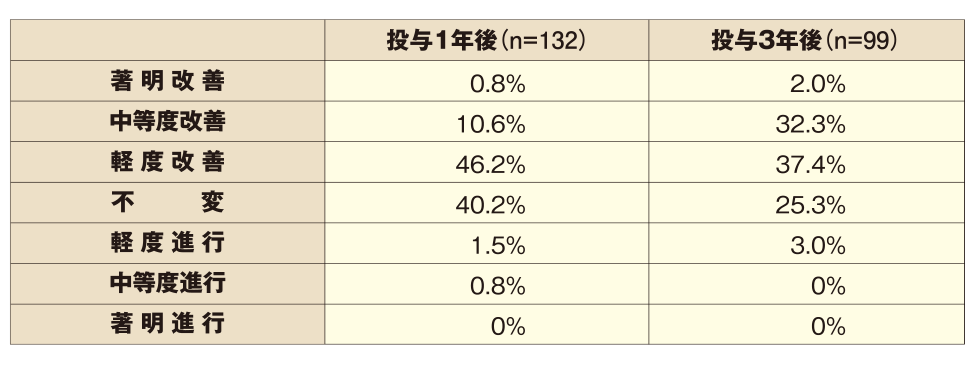
改善効果(副次評価項目:頭頂部写真評価):プロペシア®錠1mg 3年間投与
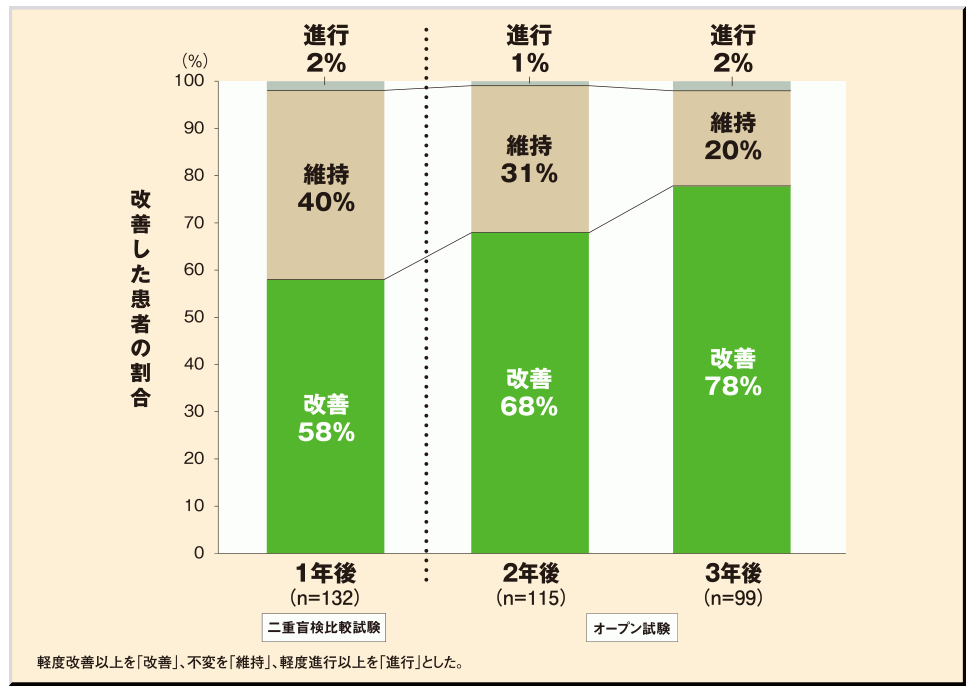
●プロペシア®錠1mgの1日1回1錠継続投与により、服用患者の98%で3年間AGA/エージーエーの進行が認められませんでした。
●プロペシア®錠1mgを1日1回1錠投与することで、投与1年後に既に毛髪状態の改善・維持を認め、3年間の継続投与にて、毛髪状態改善例の占める割合が増加しました。
試験概要
【試験】
多施設二重盲検比較試験1),2)ならびに引き続いての2年間延長試験(オープン試験)3)
日本人の男性型脱毛症(AGA/エージーエー)患者におけるプロペシア®の有効性と安全性を評価することを目的に実施
【対象】
20歳以上50歳以下で脱毛症以外には心身ともに健康なModified Norwood/ Hamilton 分類においてⅡvertex型、Ⅲvertex型、Ⅳ型、Ⅴ型に分類される中等度までの男性型脱毛症(AGA/エージーエー)患者414例
【方法】
二重盲検比較試験では、プロペシア®錠1mg、0.2mgまたはプラセボを1日1回1錠、1年(48週)間経口投与し、プラセボとの優越性を検証。引き続いてのオープン試験では、1年の二重盲検比較試験終了時点で治験参加対象者全員に継続投与の意思を確認し、同意の得られた患者に対して引き続き2年間プロペシア®錠1mgを1日1回1錠にて継続投与。 (1年毎に継続投与の意思を患者に確認)
【写真評価方法】
各評価時点[投与前、3ヵ月(12週)、6ヵ月(24週)、1年(48週)、1年6ヵ月(72週)、2年(96週)、2年6ヵ月(120週)、3年(144週)]で、頭部写真を標準化された機材、方法で撮影した。盲検下で第三者機関の熟練した皮膚科専門医(E.Olsen、R.Savin、D.Whiting)が、投与前と投与後の写真を比較して7段階(著明改善、中等度改善、軽度改善、不変、軽度進行、中等度進行、著明進行)で評価。
【評価項目】
主要評価項目 二重盲検試験:投与48週後の頭頂部写真評価(最終評価)
オープン試験:副作用発現率、有害事象発現率及び臨床検査値異常変動発現率
副次評価項目 二重盲検試験:投与12、24、48週時点の頭頂部写真評価 等
オープン試験:48週ごとの頭頂部写真評価 等
【解析計画】
二重盲検試験:用量反応性(線形回帰分析)、プロペシア®錠1mg群のプラセボ群に対する優越性(分散分析)、0.2mg群のプラセボ群に対する優越性(分散分析)、1mg群の0.2mg群に対する優越性(分散分析)解析をこの順で下降手順により実施した。
オープン試験:有害事象、副作用及び臨床検査値異常変動の発現件数と発現例数を集計し、発現率の95%信頼区間を求めた。
※効能・効果、用法・用量、禁忌を含む使用上の注意等詳細は添付文書情報をご参照ください。
