臨床成績
プロペシア®錠 臨床成績<国内データ (1年)>
1)社内資料:国内第Ⅱ/Ⅲ相二重盲検比較試験(承認時評価資料)
2)Kawashima M et al. Eur J Dermatol 2004; 14(4): 247-254.
【利益相反】本試験は万有製薬(現MSD株式会社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた))の資金援助を受け、著者のうち3名は同社の社員である。
3)社内資料:国内第Ⅱ/Ⅲ相2年間延長オープン試験(承認時評価資料)
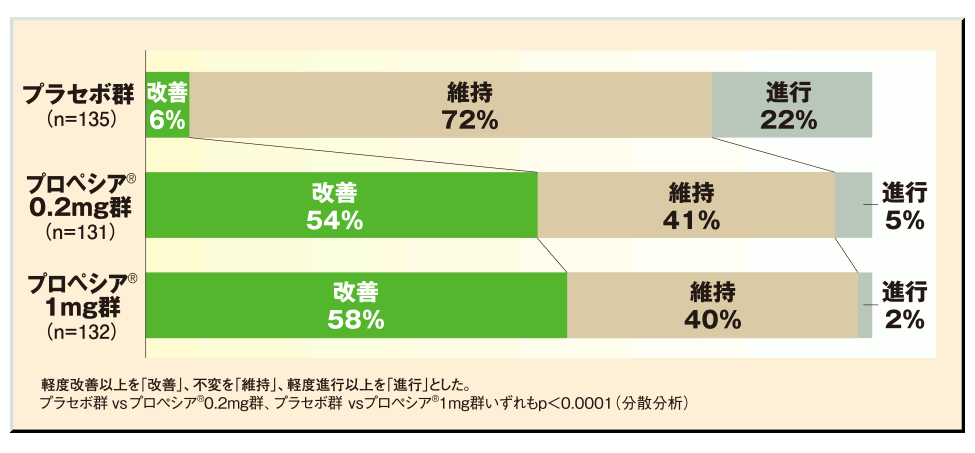
国内投与試験(1年間)におけるプロペシア®錠1mgおよび0.2mgの改善効果(主要評価項目:頭頂部写真評価)
プロペシア®錠の改善率は0.2mg群で54%、1mg群で58%であり、プラセボ群(6%)に対して優越性が示されました(p<0.0001:分散分析)。
なお、0.2mgと1mgの間には有意差が見られず、両群間において優越性は検証されませんでした1)、2)。
(1年後写真評価)
安全性
48週間の二重盲検比較試験において、臨床検査値異常変動を含む副作用発現はプロペシア®1mg群6.5%(139 例中9 例に12件)、0.2mg群1.5%(137例中2例に2件)、プラセボ群2.2%(138例中3例に4件)でした。
主な症状はプロペシア®1mg群では、勃起機能不全2例(1.4%)、射精障害、精液量減少、リビドー減退 各1例(0.7%)、プロペシア®0.2mg群では、リビドー減退2例(1.5%)、プラセボ群では、リビドー減退3例(2.2%)*等でした。死亡、重篤な副作用及び副作用による投与中止例は認められませんでした。
* 1例に「陰茎感覚異常」を併発し、件数は合計で4件発現した。
試験概要
【試験】
多施設二重盲検比較試験1),2)ならびに引き続いての2年間延長試験(オープン試験)3)
日本人の男性型脱毛症(AGA/エージーエー)患者におけるプロペシア®の有効性と安全性を評価することを目的に実施
【対象】
20歳以上50歳以下で脱毛症以外には心身ともに健康なModified Norwood/ Hamilton 分類においてⅡvertex型、Ⅲvertex型、Ⅳ型、Ⅴ型に分類される中等度までの男性型脱毛症(AGA/エージーエー)患者414例
【方法】
二重盲検比較試験では、プロペシア®錠1mg、0.2mgまたはプラセボを1日1回1錠、1年(48週)間経口投与し、プラセボとの優越性を検証。引き続いてのオープン試験では、1年の二重盲検比較試験終了時点で治験参加対象者全員に継続投与の意思を確認し、同意の得られた患者に対して引き続き2年間プロペシア®錠1mgを1日1回1錠にて継続投与。
(1年毎に継続投与の意思を患者に確認)
【写真評価方法】
各評価時点[投与前、3ヵ月(12週)、6ヵ月(24週)、1年(48週)、1年6ヵ月(72週)、2年(96週)、2年6ヵ月(120週)、3年(144週)]で、頭部写真を標準化された機材、方法で撮影した。盲検下で第三者機関の熟練した皮膚科専門医(E.Olsen、R.Savin、D.Whiting)が、投与前と投与後の写真を比較して7段階(著明改善、中等度改善、軽度改善、不変、軽度進行、中等度進行、著明進行)で評価。
【評価項目】
主要評価項目 二重盲検試験:投与48週後の頭頂部写真評価(最終評価)
オープン試験:副作用発現率、有害事象発現率及び臨床検査値異常変動発現率
副次評価項目 二重盲検試験:投与12、24、48週時点の頭頂部写真評価 等
オープン試験:48週ごとの頭頂部写真評価 等
【解析計画】
二重盲検試験:用量反応性(線形回帰分析)、プロペシア®錠1mg群のプラセボ群に対する優越性(分散分析)、0.2mg群のプラセボ群に対する優越性(分散分析)、1mg群の0.2mg群に対する優越性(分散分析)解析をこの順で下降手順により実施した。
オープン試験:有害事象、副作用及び臨床検査値異常変動の発現件数と発現例数を集計し、発現率の95%信頼区間を求めた。
※効能・効果、用法・用量、禁忌を含む使用上の注意等詳細は添付文書情報をご参照ください。