レメロン®臨床成績 プラセボ対照試験
「禁忌を含む使用上の注意」等についてはDIをご参照ください。
臨床成績:レメロン®国内第Ⅱ相二重盲検並行群間比較試験(対照薬:プラセボ)(用量検討試験)
(1)試験概要
プラセボ対照比較試験(承認時評価資料)
| 目 的: | うつ病及びうつ状態の患者を対象に、レメロン®の有効性について、プラセボ群に対するレメロン®30mg/日の優越性を検証するとともに、プラセボ群、レメロン®15mg/日群、30mg/日群及び45mg/日群の用量反応関係を推定する。 |
| 対 象: | うつ病及びうつ状態の患者280例 |
| デザイン: | プラセボ対照、多施設共同無作為化二重盲検並行群間比較試験 |
| 投与方法: | 投与群として、レメロン®15mg/日群、30mg/日群、45mg/日群及びプラセボ群の4群を設定した。 全てのレメロン®投与群で初期用量は15mg/日とし、30mg/日群及び45mg/日群は2週目に30mgへ強制増量、45mg/日群は3週目に45mgへ強制増量し、各群共に増量後は用量を維持した。 投与期間は6週間とし、1日1回、就寝前に経口投与することとした。 |
| 評価項目: | 主要評価項目:投与終了(中止)時のHAM-D合計スコア(17項目)の投与開始前からの変化量 その他の評価項目:HAM-D合計スコア(17項目)変化量の推移 |
| 解析計画: | 主要解析として、投与開始時のHAM-D合計スコア(17項目)を共変量とした共分散分析(ANCOVA)を用い、LOCFによるレメロン®30mg/日群とプラセボ群の群間比較を行った。主要解析対象集団はFAS(安全性評価症例280例より対象外疾患症例1例、HAM-D評価欠測症例9例を除外した270例)とした。また、同様の解析で、レメロン® 15mg/日群及び40mg/日群とプラセボ群の群間比較を行った。 サブグループ解析:治験実施後に投与開始7日目までの早期中止例がレメロン® 45mg/日群の結果に影響を与えていたと考えられたため、これらを除外した解析を実施した。 |
| 判定基準: | HAM-D合計スコア(17項目)の変化 |
(2)有効性
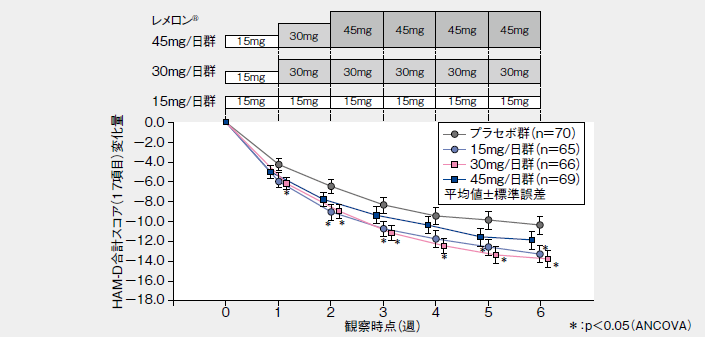
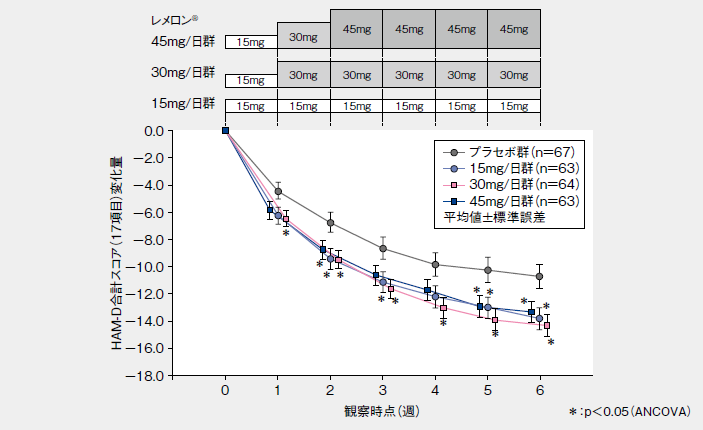
レメロン®30mg/日群の投与終了(中止)時のHAM-D合計スコア(17項目)の投与開始前からの変化量(LOCF:LastObservation Carried Forward、最終観察時引き伸ばしデータ、主要評価項目)は、プラセボ群に比較して有意に大きく、レメロン®30mg/日群のプラセボ群に対する有意差が認められた。また、レメロン®15mg/日群についてもプラセボ群に対する有意差が認められた。なお、レメロン®45mg/日群での効果は、30mg/日群を上回るものではなかった。投与開始7日目までの中止例が、45mg/日群で多く、これらを除いた集団において、投与開始前からの変化量(LOCF)を集計した結果、投与6週間後の変化量(LOCF)はプラセボ群と比較して、レメロン®のいずれの投与群においても有意な減少が認められた。
■HAM-D合計スコア(17項目)の投与終了(中止)時の変化量(LOCF、主要評価項目)
| 投与群 | 症例数 | HAM-D変化量注1) | 差注2)(95%信頼区間) |
| プラセボ群 | 70 | −10.4(7.5) | |
| レメロン®15mg/日群 | 65 | −13.3(6.8)* | −2.8(−5.3~−0.4) |
| レメロン®30mg/日群 | 66 | −13.8(6.9)* | −3.4(−5.8~−1.0) |
| レメロン®45mg/日群 | 69 | −11.9(7.6) | −1.6(−4.2~ 0.9) |
注1):平均値(標準偏差)
注2):プラセボ群に対する最小2乗平均の差の推定値
*:p<0.05 プラセボ群に対して有意差あり(ANCOVA)
■HAM-D合計スコア(17項目)変化量の推移(LOCF、その他の評価項目)
■HAM-D合計スコア(17項目)の投与終了(中止)時の変化量(LOCF、投与開始7日目までの中止例を除外、主要評価項目のサブグループ解析)
| 投与群 | 症例数 | HAM-D変化量注1) | 差注2)(95%信頼区間) |
| プラセボ群 | 67 | −10.7(7.4) | |
| レメロン®15mg/日群 | 63 | −13.8(6.5)* | −2.8(−5.3~−0.4) |
| レメロン®30mg/日群 | 64 | −14.3(6.4)* | −3.5(−5.8~−1.1) |
| レメロン®45mg/日群 | 63 | −13.3(6.3)* | −2.7(−5.1~−0.3) |
注1):平均値(標準偏差)
注2):プラセボ群に対する最小2乗平均の差の推定値
*:p<0.05 プラセボ群に対して有意差あり(ANCOVA)
■HAM-D合計スコア(17項目)変化量の推移(LOCF、投与開始7日目までの中止例を除外、その他の評価項目のサブグループ解析)
(3)安全性
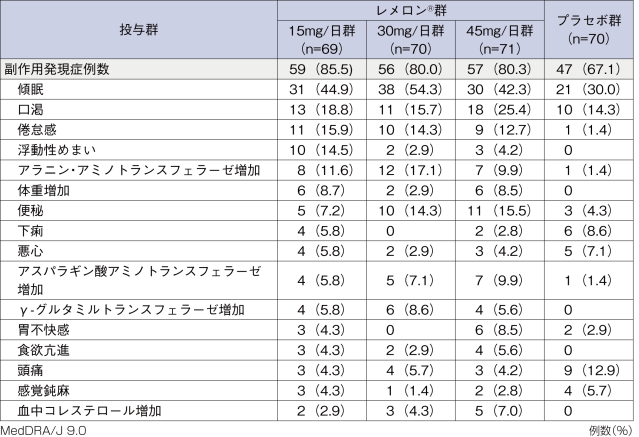
レメロン®群では、安全性評価対象症例210例中172例(81.9%)、プラセボ群では、安全性評価対象症例70例中47例(67.1%)に副作用が認められた。主なものは、レメロン®群で傾眠99例(47.1%)、口渇42例(20.0%)、プラセボ群で傾眠21例(30.0%)、口渇10例(14.3%)であった。
なお、いずれの投与群においても、死亡例を含む重篤な副作用は認められなかった。レメロン®群における投与中止に至った副作用は11例に15件(傾眠及び軽躁が各2件、味覚異常、構音障害、倦怠感、頭痛、感覚鈍麻、アラニン・アミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加、白血球数減少、躁病、胸部不快感及び発疹が各1件)に認められた。
■いずれかの投与群で5%以上発現した副作用
【用法及び用量】
通常、成人にはミルタザピンとして1日15mgを初期用量とし、15~30mgを1日1回就寝前に経口投与する。なお、年齢、症状に応じ1日45mgを超えない範囲で適宜増減するが、増量は1週間以上の間隔をあけて1日用量として15mgずつ行うこと。
