ピックアップ
喘息と鼻炎に対する効果
「禁忌を含む使用上の注意」等は製品添付文書をご参照ください。
アレルギー性鼻炎
季節性アレルギー性鼻炎に対する有用性
■安全性情報:副作用発現状況の一覧(使用成績調査)
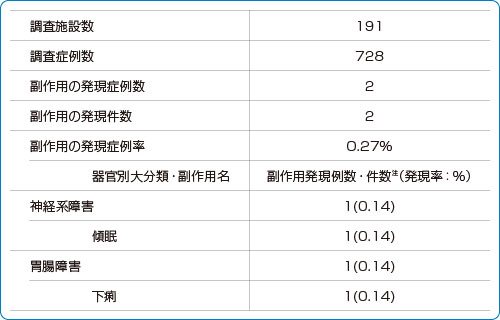
副作用名は日本語版MedDRA/J ver.14.1 を使用した。
注:副作用の器官別大分類の集計は発現例数、副作用の集計は発現件数を示した。
■有効性情報 :各鼻症状の本剤使用による全般的印象(使用成績調査)
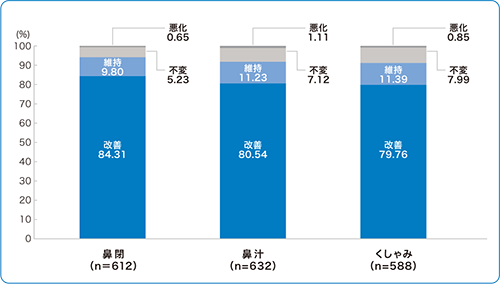
1)より改変
〈対象〉
季節性アレルギー性鼻炎患者(安全性集計対象症例728 例、有効性集計対象症例692 例)
〈方法〉
アレルギー性鼻炎に対し、モンテルカスト製剤を承認された用法・用量(通常、成人にはモンテルカストとして5~10mgを1日1回就寝前に経口投与)で新規に投与開始した、季節性アレルギー性鼻炎患者を対象に、耳鼻科、アレルギー科、内科を有する医療機関で、プロスペクティブな連続調査方式により調査を実施した。観察期間は投与開始日から最終観察日までと定義し、原則として2週間以上とした。
〈評価項目〉
日常診療における使用実態下において季節性アレルギー性鼻炎に使用された際の安全性(有害事象)および有効性(全般改善度、全般的印象)
〈解析計画〉
モンテルカスト製剤の安全性および有効性に関する情報の集計、解析を行った。副作用発現状況および有効率の患者背景別の層別解析では、カテゴリーに順序がある年齢重症度罹病期間使用期間、総投与量については、Wilcoxonの順位和検定を実施した。それ以外の項目で、自由度(DF) = 1のときはFisherの直接確率検定、DF≧2のときはχ2検定を実施した。有意水準は両側5%とした。
1)丹下 陽子 他. 新薬と臨牀 2015; 64: 1334-1356.より改変
【利益相反】本調査はMSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)により実施された。著者のうち丹下、長崎、小泉、原はMSD社員。
通年性アレルギー性鼻炎に対する有用性
■安全性情報:副作用発現状況の一覧(特定使用成績調査)
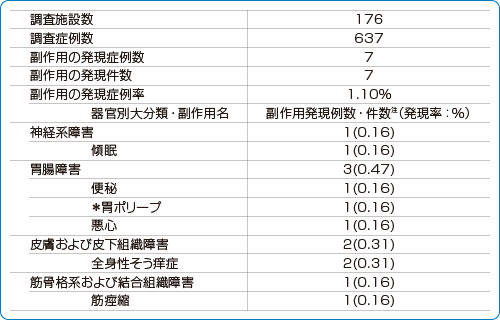
*:使用上の注意から予測できない副作用
副作用名は日本語版MedDRA/J ver.14.1 を使用した。
注:副作用の器官別大分類の集計は発現例数、副作用の集計は発現件数を示した。
■有効性情報 :各鼻症状の本剤使用による全般的印象(特定使用成績調査)
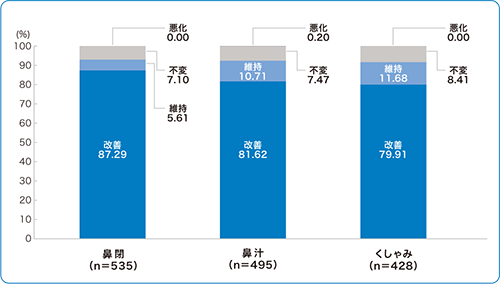
1)より改変
〈対象〉
通年性アレルギー性鼻炎患者(安全性集計対象症例637例、有効性集計対象症例583例)
〈方法〉
アレルギー性鼻炎に対し、モンテルカスト製剤を承認された用法・用量(通常、成人にはモンテルカストとして5~10mgを1日1回就寝前に経口投与) で新規に投与開始した、耳鼻科、アレルギー科、内科を有する医療機関で、プロスペクティブな連続調査方式により調査を実施した。観察期間は投与開始日から最終観察日までと定義し、原則として12週間以上とした。
〈評価項目〉
日常診療における使用実態下において通年性アレルギー性鼻炎に長期使用された際の安全性(有害事象)および有効性(全般改善度、全般的印象)
〈解析計画〉
モンテルカスト製剤の安全性および有効性に関する情報の集計、解析を行った。副作用発現状況および有効率の患者背景別の層別解析では、カテゴリーに順序がある年齢重症度罹病期間使用期間、総投与量については、Wilcoxonの順位和検定を実施した。それ以外の項目で、自由度(DF) = 1のときはFisherの直接確率検定、 DF≧2のときはχ2検定を実施した。有意水準は両側5%とした。
1)丹下 陽子 他. 新薬と臨牀 2015; 64: 1334-1356
【利益相反】本調査はMSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)により実施された。著者のうち丹下、長崎、小泉、原はMSD社員。
〈対象〉
通年性アレルギー性鼻炎患者(安全性集計対象症例637例、有効性集計対象症例583例)
〈方法〉
アレルギー性鼻炎に対し、モンテルカスト製剤を承認された用法・用量(通常、成人にはモンテルカストとして5~10mgを1日1回就寝前に経口投与) で新規に投与開始した、耳鼻科、アレルギー科、内科を有する医療機関で、プロスペクティブな連続調査方式により調査を実施した。観察期間は投与開始日から最終観察日までと定義し、原則として12週間以上とした。
〈評価項目〉
日常診療における使用実態下において通年性アレルギー性鼻炎に長期使用された際の安全性(有害事象)および有効性(全般改善度、全般的印象)
〈解析計画〉
モンテルカスト製剤の安全性および有効性に関する情報の集計、解析を行った。副作用発現状況および有効率の患者背景別の層別解析では、カテゴリーに順序がある年齢重症度罹病期間使用期間、総投与量については、Wilcoxonの順位和検定を実施した。それ以外の項目で、自由度(DF) = 1のときはFisherの直接確率検定、 DF≧2のときはχ2検定を実施した。有意水準は両側5%とした。
1)丹下 陽子 他. 新薬と臨牀 2015; 64: 1334-1356
【利益相反】本調査はMSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)により実施された。著者のうち丹下、長崎、小泉、原はMSD社員。
気管支喘息
シングレア®追加投与はACTスコア※を上昇させました(海外データ)
※ACT:Asthma Control Test 。5つの質問で構成され、それぞれを1~5のスケールで評価し、合計したスコアで喘息のコントロールの度合いを評価する。
■ACTスコアの推移(主要評価項目)
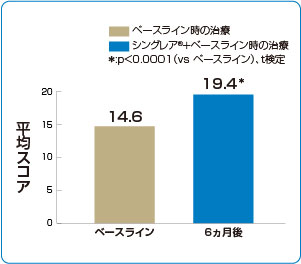
2)より作図
■シングレア®追加投与後の喘息コントロール改善効果
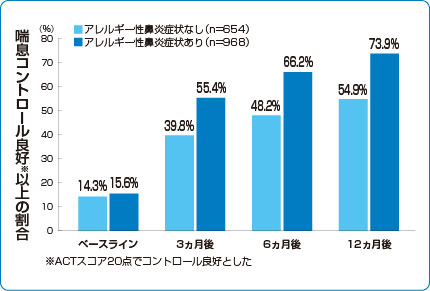
3)より作図
安全性
全症例1,681例中、103例177件(全症例のうち6.1%)に有害事象が認められ、そのうち9例が重篤な有害事象として報告されました。1例がシングレア®と無関連であると考えられる敗血症性ショックによる死亡、その他は胃癌、アレルギー性肉芽腫性血管炎(チャーグ・ストラウス症候群)、膀胱癌、半月板病変、気管支炎、喘息、および手の骨折でした。最も多く発現した有害事象は、感染(16件)、喘息(14件)、鼻咽頭炎(8件)、頭痛(7件)、嘔気(6件)でした。シングレア®との関連について、有害事象177件中77件は「関連なし」もしくは「おそらく関連なし」と判定され、68件は「関連あり」もしくは「おそらく関連あり」と判定されました。少なくともシングレア®に関連すると考えられる最も一般的な有害事象は、発疹、睡眠障害、頭痛、胸やけ、吐き気でした。
〈対象〉
18歳以上のコントロール不良の軽症・中等症喘息患者 1,681例
〈方法〉
ベースライン時の治療(ICS:n=389、ICS/LABA:n=1,169、不明:n=123)にシングレア®錠10mgを1日1回、12ヵ月間(第一試験:6ヵ月、延長試験:6ヵ月)追加投与した。シングレア®投与0、3、6、12ヵ月後に、Asthma Control Test(ACT)にて喘息コントロールを、Mini-Asthma Quality-of-Life Questionnaire(Mini AQLQ)にて喘息関連のQOLを評価した。
〈評価項目〉
主要評価項目:ACTの合計スコア
副次評価項目:Mini AQLQスコアおよび肺機能検査値(FEV1/PEF)
その他評価項目:シングレア®を追加投与し、評価項目の変動の有意性について検証を行った。
〈解析計画〉
シングレア®錠10mgの追加投与療法について有効性を検討した。研究の過程でのACT、mini-AQLQおよび肺機能検査値の変化量について、t分布を用いて95%信頼区間と有意水準5%を算出した。また、年齢(30歳未満、30~50歳、50歳以上)、性別、アレルギー性鼻炎の有無、喘息の罹病期間(5年未満、5年以上)、ICSまたはICS/LABA使用の有無に関して、それぞれサブグループ解析を行った。
2) Virchow JC et al. Respir Med 2010;104(5):644-651.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Virchow JCとMitfessel HはMSD社のアドバイザーで講演料受領。Mehta AはMSD社員。
3) Virchow JC et al. J Asthma 2010;47(9):986-993.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Christian JとVirchow JCはMSD社より講演料を受領。Mehta AはMSD社員。