製品基本情報
小児気管支喘息
「禁忌を含む使用上の注意」等は製品添付文書をご参照ください。
国内第Ⅱ相試験
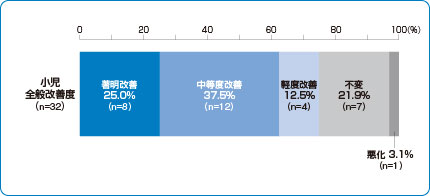
チュアブル錠 臨床成績 全般改善度
チュアブル錠 臨床成績 全般改善度
小児喘息治療薬シングレア®チュアブル錠5mgの全般改善度※
シングレア®チュアブル錠5mgは、62.5%(20例/32例)の有効率※※を示しました。
承認時評価資料
※:全般改善度評価方法
臨床症状(発作、咳、日常生活、夜間睡眠、その他の症状)、併用薬の使用状況(治療点数)ならびに患者(および保護者)の印象を観察期と比較し、下記6分類で判定
1.著明改善 2.中等度改善 3.軽度改善 4.不変 5.悪化 6.判定不能
※※:全般改善度として中等度改善以上
安全性
副作用は1例/39例(2.6%)に認められ、蕁麻疹様皮疹(丘疹状)の1例が投与中止にいたりました。
【試験】
多施設共同オープン試験
【対象】
6歳以上16歳未満の軽症・中等症#気管支喘息患者39 例(有効性解析対象例:32 例)
#日本小児アレルギー学会小児気管支喘息の発作の程度、重症度、予後判定基準による。
【方法】
2週間の観察期後、シングレア®チュアブル錠5mg を1日1回、就寝前に4週間経口投与した。なお、口内で噛み砕いて服用することとしたが、服用時に、水を飲んでも飲まなくても差し支えないこととした。
【評価項目】
主要評価項目:全般改善度、概括安全度
副次評価項目:PEF、臨床症状(発作、咳嗽、日常生活、夜間睡眠、その他の症状)、併用薬の使用状況(治療点数)、理学所見(ラ音)、一般肺機能検査(FVC、FEV1.0、FEV1.0%)、末梢血好酸球比率、患者および保護者の印象、有害事象および副作用の発現率
【解析計画】
評価項目におけるシングレア®チュアブル錠5mg の有効性および安全性を検証した。副次評価項目はクロス表、分散分析、t検定、あるいはWilcoxon検定を用いて解析した。
重要な基本的注意(抜粋)
(2)本剤は気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
(3)気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
小児喘息治療薬シングレア®チュアブル錠5mgの全般改善度※
シングレア®チュアブル錠5mgは、62.5%(20例/32例)の有効率※※を示しました。

承認時評価資料
※:全般改善度評価方法
臨床症状(発作、咳、日常生活、夜間睡眠、その他の症状)、併用薬の使用状況(治療点数)ならびに患者(および保護者)の印象を観察期と比較し、下記6分類で判定
1.著明改善 2.中等度改善 3.軽度改善 4.不変 5.悪化 6.判定不能
※※:全般改善度として中等度改善以上
安全性
副作用は1例/39例(2.6%)に認められ、蕁麻疹様皮疹(丘疹状)の1例が投与中止にいたりました。
【試験】
多施設共同オープン試験
【対象】
6歳以上16歳未満の軽症・中等症#気管支喘息患者39 例(有効性解析対象例:32 例)
#日本小児アレルギー学会小児気管支喘息の発作の程度、重症度、予後判定基準による。
【方法】
2週間の観察期後、シングレア®チュアブル錠5mg を1日1回、就寝前に4週間経口投与した。なお、口内で噛み砕いて服用することとしたが、服用時に、水を飲んでも飲まなくても差し支えないこととした。
【評価項目】
主要評価項目:全般改善度、概括安全度
副次評価項目:PEF、臨床症状(発作、咳嗽、日常生活、夜間睡眠、その他の症状)、併用薬の使用状況(治療点数)、理学所見(ラ音)、一般肺機能検査(FVC、FEV1.0、FEV1.0%)、末梢血好酸球比率、患者および保護者の印象、有害事象および副作用の発現率
【解析計画】
評価項目におけるシングレア®チュアブル錠5mg の有効性および安全性を検証した。副次評価項目はクロス表、分散分析、t検定、あるいはWilcoxon検定を用いて解析した。
重要な基本的注意(抜粋)
(2)本剤は気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
(3)気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
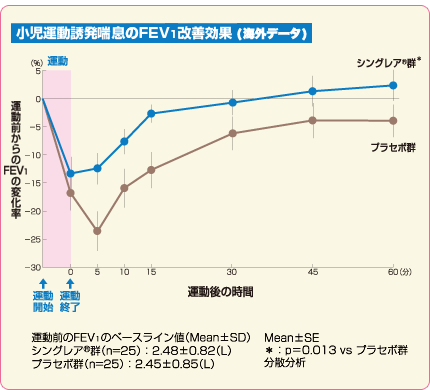
チュアブル錠 臨床成績 小児運動誘発喘息のFEV1
運動誘発試験
小児喘息治療薬シングレア®チュアブル錠5mgの運動誘発喘息改善効果(主要評価項目 海外データ)
シングレア®チュアブル錠5mgは、小児運動誘発喘息のFEV1を改善しました1)。
1)より
安全性
有害事象の発現件数は14件(プラセボ群8例、シングレア®群6例)でしたが、すべて一過性で自然に回復しました。本試験における投与中止例は、プラセボ群で2例(喘息悪化1例、プロトコール違反1例)でした。
【試験】
多施設共同無作為プラセボ対照二重盲検クロスオーバー比較試験
【対象】
6~14歳の喘息患者 27例
FEV1は予測値の70%以上、運動負荷でFEV1が20%以上低下する患者
【方法】
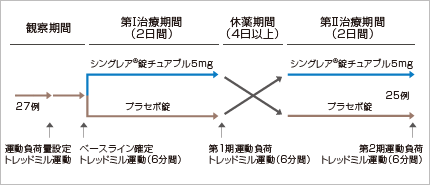
【評価項目】
主要評価項目:運動前からのFEV1変化率
副次評価項目:経時的なFEV1変化率の低下量 、FEV1回復時間
【解析計画】
評価項目におけるシングレア®チュアブル錠5mgのプラセボに対する優越性について検証した。主要評価項目は、分散分析を用いて解析した。
*シングレア®群はプラセボ群と比較して、経時的なFEV1変化率の減少量(ベースラインと0~60分の経時的FEV1変化率曲線上で作られる面積:AAC0-60min)が有意に少なかった。(p≦0.05、分散分析)
重要な基本的注意(抜粋)
(2)本剤は気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
(3)気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
1)Kemp JP et al. J Pediatr 1998;133(3):424-428.
[利益相反] MSD米国研究所(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Kemp JP、Dockhorn RJ、Shapiro GGはMSD社からコンサルタント料または研究助成金を受領。共著者のNguyen HH、Reiss TF、Seidenberg BC、Knorr BはMSD米国研究所員。
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
小児喘息治療薬シングレア®チュアブル錠5mgの運動誘発喘息改善効果(主要評価項目 海外データ)
シングレア®チュアブル錠5mgは、小児運動誘発喘息のFEV1を改善しました1)。

1)より
安全性
有害事象の発現件数は14件(プラセボ群8例、シングレア®群6例)でしたが、すべて一過性で自然に回復しました。本試験における投与中止例は、プラセボ群で2例(喘息悪化1例、プロトコール違反1例)でした。
【試験】
多施設共同無作為プラセボ対照二重盲検クロスオーバー比較試験
【対象】
6~14歳の喘息患者 27例
FEV1は予測値の70%以上、運動負荷でFEV1が20%以上低下する患者
【方法】

【評価項目】
主要評価項目:運動前からのFEV1変化率
副次評価項目:経時的なFEV1変化率の低下量 、FEV1回復時間
【解析計画】
評価項目におけるシングレア®チュアブル錠5mgのプラセボに対する優越性について検証した。主要評価項目は、分散分析を用いて解析した。
*シングレア®群はプラセボ群と比較して、経時的なFEV1変化率の減少量(ベースラインと0~60分の経時的FEV1変化率曲線上で作られる面積:AAC0-60min)が有意に少なかった。(p≦0.05、分散分析)
重要な基本的注意(抜粋)
(2)本剤は気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
(3)気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
1)Kemp JP et al. J Pediatr 1998;133(3):424-428.
[利益相反] MSD米国研究所(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。Kemp JP、Dockhorn RJ、Shapiro GGはMSD社からコンサルタント料または研究助成金を受領。共著者のNguyen HH、Reiss TF、Seidenberg BC、Knorr BはMSD米国研究所員。
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
チュアブル錠 臨床成績 FEV1
海外第Ⅲ相試験
小児喘息治療薬シングレア®チュアブル錠5mgの喘息改善効果(主要評価項目 検証解析結果 海外データ)
シングレア®チュアブル錠5mgは、小児の呼吸機能において有意な改善が認められました(p<0.01、分散分析、検証的な解析結果)2)。
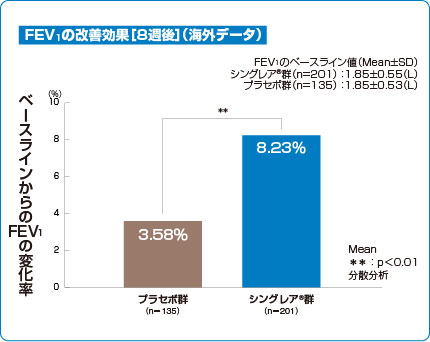
2)より作図
安全性
有害事象で最も多く発現したのは、頭痛、喘息悪化、上気道感染でした。有害事象の発現率は、シングレア®群で上気道感染23.9%、頭痛18.9%、喘息悪化16.4%、プラセボ群で上気道感染29.6%、頭痛21.5%、喘息悪化22.2%でした。また、本試験における有害事象を含めた投与中止例は、シングレア®群で12例〔喘息悪化 5例、肺炎 1例、 脱水 1例、 上気道感染 1例、 追跡調査不能1例、 試験同意拒否 2例、好中球減少 1例(ただし、 治療開始前から存在)〕、プラセボ群で10例(喘息悪化 2例、蕁麻疹 1例、プロトコール違反 1例、追跡調査不能 1例、試験同意拒否 5例)でした。
【試験】
多施設共同無作為プラセボ対照二重盲検群間比較試験
【対象】
6~14歳の喘息患者 336例
FEV1は予測値の50~85%、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:8週間後のFEV1変化率
副次評価項目:β2刺激薬の使用数、日中症状スコア・ピークフロー値、夜間の目覚め日数、
QOLスコア、学校欠席日数、末梢血好酸球数の変化
【解析計画】
評価項目におけるシングレア®チュアブル錠5mgのプラセボに対する優越性について検証した。主要評価項目は、分散分析を用いて解析した。
重要な基本的注意(抜粋)
(2)本剤は気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
(3)気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
2)Knorr B et al. JAMA 1998;279(15):1181-1186.
[利益相反]
MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。共著者のKnorr B、Seidenberg BC 、Reiss TF 、Nguyen HはMSD米国研究所員。
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
小児喘息治療薬シングレア®チュアブル錠5mgの喘息改善効果(主要評価項目 検証解析結果 海外データ)
シングレア®チュアブル錠5mgは、小児の呼吸機能において有意な改善が認められました(p<0.01、分散分析、検証的な解析結果)2)。

2)より作図
安全性
有害事象で最も多く発現したのは、頭痛、喘息悪化、上気道感染でした。有害事象の発現率は、シングレア®群で上気道感染23.9%、頭痛18.9%、喘息悪化16.4%、プラセボ群で上気道感染29.6%、頭痛21.5%、喘息悪化22.2%でした。また、本試験における有害事象を含めた投与中止例は、シングレア®群で12例〔喘息悪化 5例、肺炎 1例、 脱水 1例、 上気道感染 1例、 追跡調査不能1例、 試験同意拒否 2例、好中球減少 1例(ただし、 治療開始前から存在)〕、プラセボ群で10例(喘息悪化 2例、蕁麻疹 1例、プロトコール違反 1例、追跡調査不能 1例、試験同意拒否 5例)でした。
【試験】
多施設共同無作為プラセボ対照二重盲検群間比較試験
【対象】
6~14歳の喘息患者 336例
FEV1は予測値の50~85%、β2刺激薬吸入後FEV1が15%以上改善する患者
【方法】

【評価項目】
主要評価項目:8週間後のFEV1変化率
副次評価項目:β2刺激薬の使用数、日中症状スコア・ピークフロー値、夜間の目覚め日数、
QOLスコア、学校欠席日数、末梢血好酸球数の変化
【解析計画】
評価項目におけるシングレア®チュアブル錠5mgのプラセボに対する優越性について検証した。主要評価項目は、分散分析を用いて解析した。
重要な基本的注意(抜粋)
(2)本剤は気管支拡張剤、ステロイド剤などと異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
(3)気管支喘息患者に本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
2)Knorr B et al. JAMA 1998;279(15):1181-1186.
[利益相反]
MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。共著者のKnorr B、Seidenberg BC 、Reiss TF 、Nguyen HはMSD米国研究所員。
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
チュアブル錠 臨床成績 呼気中NO濃度
小児喘息治療薬シングレア®チュアブル錠5mgの気道炎症改善効果
シングレア®チュアブル錠5mgは、気道炎症の指標である呼気中一酸化窒素(NO)濃度を低下させました3)。
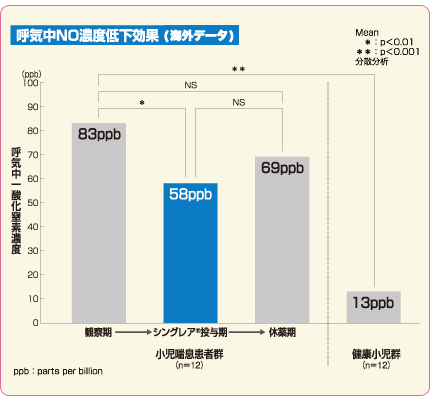
3)より
【副作用】
論文中に副作用に関する記載がないため、添付文書をご参照ください。
【試験】
オープン比較試験
【対象】
6~11歳の軽症~中等症の喘息患者 12例
吸入β2刺激薬を頓用し、FEV1は予測値の60~85%、β2刺激薬吸入後FEV1が12%以上改善する患者
【方法】
患者の年齢と性別を一致させた健康小児12例を対照群とした。
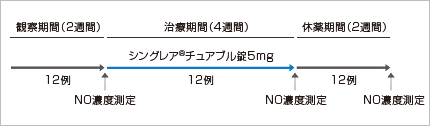
【評価項目】
投与前後における呼気中NO濃度の比較
【解析計画】
シングレア®チュアブル錠5mg投与による影響を健康小児と比較検討した。観察期間、治療期間、休薬期間終了時の各呼気中NO濃度について分散分析を用いて比較し、観察期間終了時の呼気中NO濃度については健康小児群とも分散分析を用いて比較した。
小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
3)Bratton DL et al.Pediatr Pulmono/ 1999;28(6):402-407.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
シングレア®チュアブル錠5mgは、気道炎症の指標である呼気中一酸化窒素(NO)濃度を低下させました3)。

3)より
【副作用】
論文中に副作用に関する記載がないため、添付文書をご参照ください。
【試験】
オープン比較試験
【対象】
6~11歳の軽症~中等症の喘息患者 12例
吸入β2刺激薬を頓用し、FEV1は予測値の60~85%、β2刺激薬吸入後FEV1が12%以上改善する患者
【方法】
患者の年齢と性別を一致させた健康小児12例を対照群とした。

【評価項目】
投与前後における呼気中NO濃度の比較
【解析計画】
シングレア®チュアブル錠5mg投与による影響を健康小児と比較検討した。観察期間、治療期間、休薬期間終了時の各呼気中NO濃度について分散分析を用いて比較し、観察期間終了時の呼気中NO濃度については健康小児群とも分散分析を用いて比較した。
小児等への投与
(1)1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。(国内でのモンテルカスト製剤の使用経験がない。)
3)Bratton DL et al.Pediatr Pulmono/ 1999;28(6):402-407.
【利益相反】MSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた。以下同様)が本研究に資金提供。
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
チュアブル錠 安全性
自他覚的副作用(承認時)
国内で実施された臨床試験において、96例中2例(2.1%)に2件の副作用が認められ、副作用は蕁麻疹様皮疹、浮動性めまい各1件(1.0%)でした。(承認時)


(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
国内で実施された特定使用成績調査における安全性評価対象1,194例中8例(0.7%)に9件(臨床検査値異常を含む)の副作用が認められ、副作用は、悪心2件(0.2%)、嘔吐、頭痛、チック、湿疹、多形紅斑、蕁麻疹、潮紅各1件(0.1%)でした。
国内で実施された製造販売後臨床試験4)、5)における安全性評価対象134例中9例(6.7%)に12件(臨床検査値異常を含む)の副作用が認められ、副作用は、尿中蛋白陽性2件(1.5%)、悪心、頭痛、月経障害、感情不安定、白血球数増加、総蛋白増加、血中ビリルビン増加、血中クレアチンホスホキナーゼ増加、血中尿素増加、尿中ウロビリン陽性各1件(0.7%)でした。(再審査終了時)
(参考:外国試験成績)
外国で実施された小児気管支喘息患者を対象とした長期投与試験6)において、172例中10例(5.8%)に13件の副作用が認められました。主な副作用は頭痛3件(1.7%)、消化不良2件(1.2%)、鼓腸2件(1.2%)等でした。臨床検査値の異常変動は総ビリルビン上昇1件が認められました。
4)西間 三馨 他. 臨床医薬 2005; 21(6): 605-636.
5)Kondo N et al. Allergol lnt 2006; 55(3): 287-293.
6)Storms W et al. Clin Exp Allergy 2001; 31(1): 77-87.
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
国内で実施された臨床試験において、96例中2例(2.1%)に2件の副作用が認められ、副作用は蕁麻疹様皮疹、浮動性めまい各1件(1.0%)でした。(承認時)


(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
国内で実施された特定使用成績調査における安全性評価対象1,194例中8例(0.7%)に9件(臨床検査値異常を含む)の副作用が認められ、副作用は、悪心2件(0.2%)、嘔吐、頭痛、チック、湿疹、多形紅斑、蕁麻疹、潮紅各1件(0.1%)でした。
国内で実施された製造販売後臨床試験4)、5)における安全性評価対象134例中9例(6.7%)に12件(臨床検査値異常を含む)の副作用が認められ、副作用は、尿中蛋白陽性2件(1.5%)、悪心、頭痛、月経障害、感情不安定、白血球数増加、総蛋白増加、血中ビリルビン増加、血中クレアチンホスホキナーゼ増加、血中尿素増加、尿中ウロビリン陽性各1件(0.7%)でした。(再審査終了時)
(参考:外国試験成績)
外国で実施された小児気管支喘息患者を対象とした長期投与試験6)において、172例中10例(5.8%)に13件の副作用が認められました。主な副作用は頭痛3件(1.7%)、消化不良2件(1.2%)、鼓腸2件(1.2%)等でした。臨床検査値の異常変動は総ビリルビン上昇1件が認められました。
4)西間 三馨 他. 臨床医薬 2005; 21(6): 605-636.
5)Kondo N et al. Allergol lnt 2006; 55(3): 287-293.
6)Storms W et al. Clin Exp Allergy 2001; 31(1): 77-87.
小児喘息治療薬シングレア®チュアブル錠5mgのご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については 製品添付文書 をご参照ください。
細粒 臨床成績 安全性 全般改善度
国内第Ⅲ相長期投与試験
安全性(主要評価項目)
安全性解析対象例72例のうち、副作用発現例は1例(1.4%)であり、軽度の皮膚乾燥1件でした。臨床検査値を測定した72例のうち、臨床検査値異常発現例はありませんでした。本試験において死亡例はなく、重篤な副作用は発現しませんでした7)。
最終全般改善度
シングレア®細粒4mgは、89.4%(59例/66例)の有効率※を示しました。
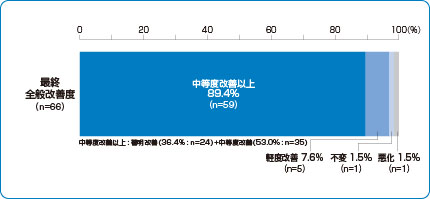
承認時評価資料
【評価方法】
最終全般改善度は、8週終了時(または中止時)に、時期別全般改善度(観察期2週間と、4週時、8週時の臨床症状および併用薬の使用状況を比較し判定)の推移ならびに患者および保護者(代諾者)の印象を考慮して下記6分類で判定した。
1.著明改善 2.中等度改善 3.軽度改善 4.不変 5.悪化 6.判定不能
※最終全般改善度として中等度改善以上
【試験】
多施設共同非盲検非対照試験
【対象】
1歳以上6歳未満の軽症・中等症#気管支喘息患者72例(有効性解析対象例:66例)
ただし、2歳未満の患者に関しては、病歴において3回以上の発作(軽い喘鳴または軽い陥没呼吸等)があり、喘息の診断が確定している患者。
#日本小児アレルギー学会小児気管支喘息の発作の程度、重症度、予後判定基準による。
【方法】
2週間の観察期後、シングレア®細粒4mgを1日1回、就寝前に8週間経口投与した。なお、スプーン1杯程度のやわらかい食物(室温以下)とともに直ちに服用することも可能とした。
【評価項目】
主要評価項目:概括安全度
副次評価項目:有害事象、臨床検査値の推移
その他の評価項目:小発作の回数
【解析計画】
シングレア®細粒4mgの安全性および有効性を検証した。
7)古庄 巻史, 西間 三馨 他. 臨床医薬 2005; 21(10): 1019-1029.
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
安全性(主要評価項目)
安全性解析対象例72例のうち、副作用発現例は1例(1.4%)であり、軽度の皮膚乾燥1件でした。臨床検査値を測定した72例のうち、臨床検査値異常発現例はありませんでした。本試験において死亡例はなく、重篤な副作用は発現しませんでした7)。
最終全般改善度
シングレア®細粒4mgは、89.4%(59例/66例)の有効率※を示しました。

承認時評価資料
【評価方法】
最終全般改善度は、8週終了時(または中止時)に、時期別全般改善度(観察期2週間と、4週時、8週時の臨床症状および併用薬の使用状況を比較し判定)の推移ならびに患者および保護者(代諾者)の印象を考慮して下記6分類で判定した。
1.著明改善 2.中等度改善 3.軽度改善 4.不変 5.悪化 6.判定不能
※最終全般改善度として中等度改善以上
【試験】
多施設共同非盲検非対照試験
【対象】
1歳以上6歳未満の軽症・中等症#気管支喘息患者72例(有効性解析対象例:66例)
ただし、2歳未満の患者に関しては、病歴において3回以上の発作(軽い喘鳴または軽い陥没呼吸等)があり、喘息の診断が確定している患者。
#日本小児アレルギー学会小児気管支喘息の発作の程度、重症度、予後判定基準による。
【方法】
2週間の観察期後、シングレア®細粒4mgを1日1回、就寝前に8週間経口投与した。なお、スプーン1杯程度のやわらかい食物(室温以下)とともに直ちに服用することも可能とした。
【評価項目】
主要評価項目:概括安全度
副次評価項目:有害事象、臨床検査値の推移
その他の評価項目:小発作の回数
【解析計画】
シングレア®細粒4mgの安全性および有効性を検証した。
7)古庄 巻史, 西間 三馨 他. 臨床医薬 2005; 21(10): 1019-1029.
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
細粒 臨床成績 症状改善効果
症状改善効果(小発作回数)
シングレア®細粒4mgは、小発作回数を有意に減少させました7)。
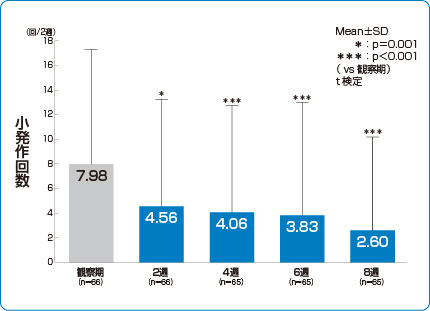
7)より作図
安全性(主要評価項目)
安全性解析対象例72例のうち、副作用発現例は1例(1.4%)であり、軽度の皮膚乾燥1件でした。臨床検査値を測定した72例のうち、臨床検査値異常発現例はありませんでした。本試験において死亡例はなく、重篤な副作用は発現しませんでした7)。
【評価方法】
小発作回数※※は、患者の保護者(代諾者)により記載された喘息日記中の小発作回数について、観察期2週間の平均小発作回数と治療期2~8週時のものと比較し評価した。
※※小発作:軽い喘鳴があり、軽い陥没呼吸を伴うこともある症状
【試験】
多施設共同非盲検非対照試験
【対象】
1歳以上6歳未満の軽症・中等症#気管支喘息患者72例(有効性解析対象例:66例)
ただし、2歳未満の患者に関しては、病歴において3回以上の発作(軽い喘鳴または軽い陥没呼吸等)があり、喘息の診断が確定している患者。
#日本小児アレルギー学会小児気管支喘息の発作の程度、重症度、予後判定基準による。
【方法】
2週間の観察期後、シングレア®細粒4mgを1日1回、就寝前に8週間経口投与した。なお、スプーン1杯程度のやわらかい食物(室温以下)とともに直ちに服用することも可能とした。
【評価項目】
主要評価項目:概括安全度
副次評価項目:有害事象、臨床検査値の推移
その他の評価項目:小発作の回数
【解析計画】
シングレア®細粒4mgの安全性および有効性を検証した。症状改善効果は、t検定を用いて解析した。
7)古庄 巻史, 西間 三馨 他. 臨床医薬 2005; 21(10): 1019-1029.
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
シングレア®細粒4mgは、小発作回数を有意に減少させました7)。

7)より作図
安全性(主要評価項目)
安全性解析対象例72例のうち、副作用発現例は1例(1.4%)であり、軽度の皮膚乾燥1件でした。臨床検査値を測定した72例のうち、臨床検査値異常発現例はありませんでした。本試験において死亡例はなく、重篤な副作用は発現しませんでした7)。
【評価方法】
小発作回数※※は、患者の保護者(代諾者)により記載された喘息日記中の小発作回数について、観察期2週間の平均小発作回数と治療期2~8週時のものと比較し評価した。
※※小発作:軽い喘鳴があり、軽い陥没呼吸を伴うこともある症状
【試験】
多施設共同非盲検非対照試験
【対象】
1歳以上6歳未満の軽症・中等症#気管支喘息患者72例(有効性解析対象例:66例)
ただし、2歳未満の患者に関しては、病歴において3回以上の発作(軽い喘鳴または軽い陥没呼吸等)があり、喘息の診断が確定している患者。
#日本小児アレルギー学会小児気管支喘息の発作の程度、重症度、予後判定基準による。
【方法】
2週間の観察期後、シングレア®細粒4mgを1日1回、就寝前に8週間経口投与した。なお、スプーン1杯程度のやわらかい食物(室温以下)とともに直ちに服用することも可能とした。
【評価項目】
主要評価項目:概括安全度
副次評価項目:有害事象、臨床検査値の推移
その他の評価項目:小発作の回数
【解析計画】
シングレア®細粒4mgの安全性および有効性を検証した。症状改善効果は、t検定を用いて解析した。
7)古庄 巻史, 西間 三馨 他. 臨床医薬 2005; 21(10): 1019-1029.
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
細粒 安全性
自他覚的副作用(承認時)
国内で実施された臨床試験において、137例中3例(2.2%)に4件の副作用が認められました。副作用は頭痛1件、悪心1件、皮膚乾燥1件、発疹1件でした。(承認時)
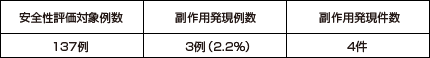

(承認時社内集計)
臨床検査値異常(承認時)
臨床検査値の異常変動はAI-P増加2件が認められました。(承認時)


(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
国内で実施された特定使用成績調査における安全性評価対象1,406例中6例(0.4%)に7件(臨床検査値異常を含む)の副作用が認められ、副作用は、動悸、胃腸炎、蛋白尿、咽喉乾燥、口腔咽頭不快感、紫斑、蕁麻疹各1件(0.1%)でした。(再審査終了時)
(参考:外国試験成績)
外国で実施された6ヶ月以上32ヶ月未満の小児気管支喘息患者を対象とした長期投与試験8)において、158例中8例(5.1%)に9件の副作用が認められました。副作用は運動過多4件(2.5%)、成長障害1件(0.6%)、便習慣変化1件(0.6%)、嘔吐1件(0.6%)、異夢1件(0.6%)、睡眠障害1件(0.6%)でした。臨床検査値の異常変動は、認められませんでした。
外国で実施された2歳以上6歳未満小児気管支喘息患者を対象とした長期投与試験9)において、364例中12例(3.3%)に19件の副作用が認められました。主な副作用は、口渇3件(0.8%)、頭痛3件(0.8%)、腹痛2件(0.5%)、蕁麻疹2件(0.5%)等でした。臨床検査値の異常変動は、7例(2.0%)に11件認められ、主なものは白血球数減少3件、AST(GOT)上昇2件等でした。
小児等への投与
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。〔国内でのモンテルカスト製剤の使用経験がない。〕
8)Van Adelsberg J et al.Am J Respir Crit Care Med 2003;167(7):A271.
9)Bisgaard H et al.Eur Respir J 2000;16(Suppl 31):307.
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。
国内で実施された臨床試験において、137例中3例(2.2%)に4件の副作用が認められました。副作用は頭痛1件、悪心1件、皮膚乾燥1件、発疹1件でした。(承認時)
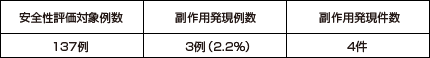

(承認時社内集計)
臨床検査値異常(承認時)
臨床検査値の異常変動はAI-P増加2件が認められました。(承認時)


(承認時社内集計)
副作用[臨床検査値異常を含む](再審査終了時)
国内で実施された特定使用成績調査における安全性評価対象1,406例中6例(0.4%)に7件(臨床検査値異常を含む)の副作用が認められ、副作用は、動悸、胃腸炎、蛋白尿、咽喉乾燥、口腔咽頭不快感、紫斑、蕁麻疹各1件(0.1%)でした。(再審査終了時)
(参考:外国試験成績)
外国で実施された6ヶ月以上32ヶ月未満の小児気管支喘息患者を対象とした長期投与試験8)において、158例中8例(5.1%)に9件の副作用が認められました。副作用は運動過多4件(2.5%)、成長障害1件(0.6%)、便習慣変化1件(0.6%)、嘔吐1件(0.6%)、異夢1件(0.6%)、睡眠障害1件(0.6%)でした。臨床検査値の異常変動は、認められませんでした。
外国で実施された2歳以上6歳未満小児気管支喘息患者を対象とした長期投与試験9)において、364例中12例(3.3%)に19件の副作用が認められました。主な副作用は、口渇3件(0.8%)、頭痛3件(0.8%)、腹痛2件(0.5%)、蕁麻疹2件(0.5%)等でした。臨床検査値の異常変動は、7例(2.0%)に11件認められ、主なものは白血球数減少3件、AST(GOT)上昇2件等でした。
小児等への投与
(2)1歳未満の乳児、新生児、低出生体重児に対するモンテルカスト製剤の安全性は確立していない。〔国内でのモンテルカスト製剤の使用経験がない。〕
8)Van Adelsberg J et al.Am J Respir Crit Care Med 2003;167(7):A271.
9)Bisgaard H et al.Eur Respir J 2000;16(Suppl 31):307.
本剤のご使用にあたり、【効能・効果】、【用法・用量】、【禁忌を含む使用上の注意】【用法、用量に関連する使用上の注意】等については、 製品添付文書 をご参照ください。