製品基本情報
【参考情報】 消退出血への影響(国内第Ⅲ相長期投与試験)
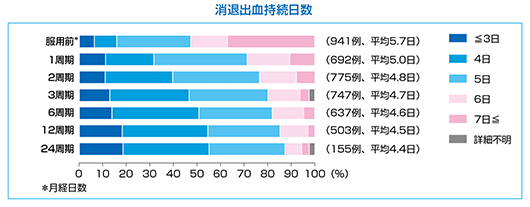
消退出血持続日数
マーベロン®投与中の消退出血持続日数は、服用前に40%近くみられた7日以上の症例は服用中10%前後となった。服用12周期目以降では、50%以上が消退出血持続日数は4日以内であった。
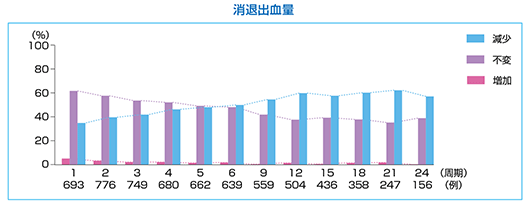
消退出血量
マーベロン®投与による消退出血量への影響を検討した結果、「不変」例の割合は1周期目で60%以上あったが、12周期目以降は「減少」が約60%、「不変」が約40%であった。
安全性
主な副作用は嘔気117例(12.29%)、乳房痛83例(8.72%)、頭痛57例(5.99%)等であった。投与中止に至った副作用は76例104件で認められ、主な投与中止例は嘔気19例、不正出血15例、倦怠感8例等であった。
目 的 :マーベロン®21の長期投与による避妊効果ならびに安全性、及びマーベロン®28の避妊効果・安全性ならびに実用性を検討する目的で臨床試験を行った。
対 象 :正常な月経周期を有する20歳以上40歳未満の妊娠可能な女性。評価対象症例数は933例。
投与方法:第1周期目は月経の第1日目より本剤1錠を就寝前に21日間連続経口投与、第2周期目からは消退出血の有無に拘わらず7日間の休薬期間の後、8日目より同様に21日間連続経口投与とし、24周期を目標に可能な限り長期間実施した。
評価項目・判定基準:服用日誌、問診ならびに各検査の結果をもとに、避妊効果、安全度、有用度、消失出血量について主治医が判定した。
解析計画:世話人・幹事会において除外規定抵触例等の問題症例、ならびに集計基準等のデータの取扱いについて検討を行い、集計対象例を決定した。避妊効果ならびに周期調節性の集計に関しては、あらかじめ決めた取扱い基準に従って実施した。
承認時評価資料 [水野正彦 他. 産科と婦人科 1990 ; 57(12) : 2507-2532.]
製剤提供はMSD社(会社分割によりウィメンズヘルス及びレガシーブランド関連の特定の製品の事業に関する権利義務をオルガノン株式会社に承継させた)が行った
重要な基本的注意
9.4 特定の背景を有する患者に関する注意
9.4.3. 生殖能を有する者
服用中に消退出血が2周期連続して発来しなかった場合、投与継続に先だって妊娠していないことを確認すること。