臨床成績
ガニレスト®の臨床成績
禁忌を含む使用上の注意の改訂に十分ご留意ください。
ガニレスト®の承認申請に用いた臨床試験の概要
外国におけるガニレスト®の臨床開発は、第Ⅱ相試験が1996年から、第Ⅲ相試験が1997年から開始された。国内では、外国での開発で得られた結果を検討した結果、IVF-ET(体外受精-胚移植)の領域では、地域間で医療習慣、疾病の定義、診断及び治療方法などの外因性要因において大きな差が認められていないことから外国臨床データを日本人に外挿することができると考え、2001年に本剤のブリッジング戦略に基づく臨床開発を開始した。この結果をもとに、本剤の有効性及び安全性を評価し、2008年7月に「調節卵巣刺激下における早発排卵の防止」の製造販売承認を取得した。
国内第Ⅱ相ブリッジング試験
本試験は至適用量探索のため、一部承認外の用量を投与した症例が含まれます。本製品の用法及び用量はガニレリクスとして0.25mgを1日1回皮下に連日投与です。
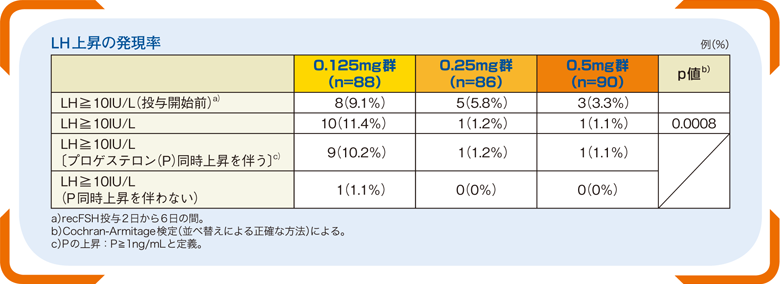
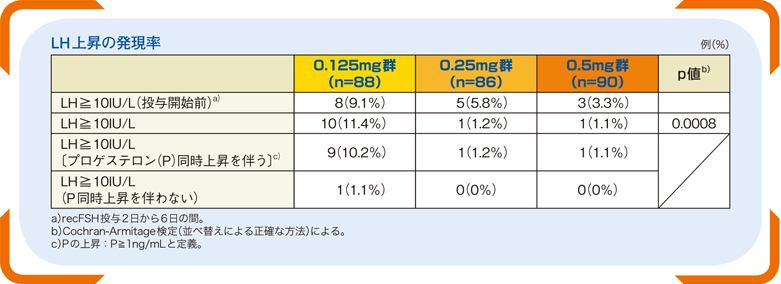
■LH上昇の発現率(主要評価項目)
ガニレスト®投与が行われた患者では、計16例(6.0%)(0.125mg群8例、0.25mg群5例、0.5mg群3例)にガニレスト®投与前にLH上昇(LH≧10IU/L)が認められた。0.25mg群の1例を除き、全てのLH上昇はガニレスト®投与開始日に発現した。
ガニレスト®投与中のLH上昇の発現率は0.125mgで11.4%、0.25mg群で1.2%、0.5mg群で1.1%であった
■ガニレスト®投与例あたり及び胚移植例あたりの胎児心拍陽性妊娠率(主要評価項目)
ガニレスト®0.25mg投与例あたりの胎児心拍陽性妊娠率は23.8%(20例/84例)、胚移植例あたりの胎児心拍陽性妊娠率は25.6%(20例/78例)であった。
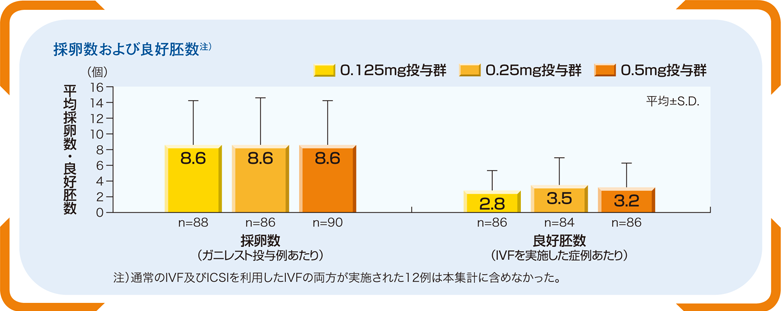
■採卵数及び良好胚数(副次評価項目)
採卵数はどの投与用量群でも下記の通りだった。
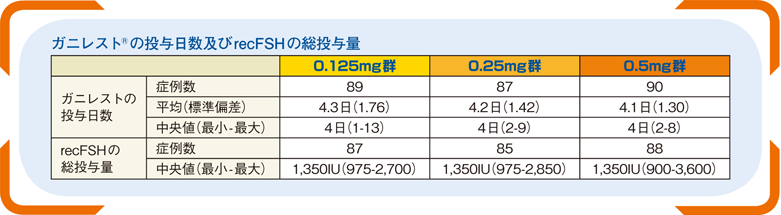
■ガニレスト®の投与日数及びrecFSHの総投与量(その他の評価項目)
ガニレスト®の投与日数の中央値は全群4日であり、recFSHの総投与量の中央値は全群1,350IUであった。
■安全性
主な有害事象は「卵巣過剰症候群(OHSS)」〔0.125mg、0.25mg及び0.5mg群でそれぞれ5例(5.6%)、6例(6.9%)、10例(11.1%)〕であった。副作用は3例に発現し、錯感覚1件、動悸1件、倦怠感1件、注射部位紅斑2件及び注射部位浮腫2件[うちガニレスト0.25mg投与群で各々1件(1.1%)]であった。
対 象:recFSHを用いた調節卵巣刺激とIVFを実施する不妊夫婦の健康な女性266例
評価項目:主要評価項目をガニレスト®投与中の血清中LH上昇及び胎児心拍陽性妊娠率とし、副次評価項目を採卵数及び良好胚数とした。
投与方法:recFSHは月経周期の2日目あるいは3日目に投与を開始した。1日1回150IUのrecFSH皮下投与5日後にガニレスト®の投与(0.125mg、0.25mg、0.5mg)を開始した。ガニレスト®投与期間中、個々の患者の卵巣の反応によってrecFSHの投与量を調節できることとした。その後、17mm以上の卵胞が少なくとも3個確認できるまで、ガニレスト®とrecFSHの投与を最大14日間継続した。
試験の種類:多施設共同、二重盲検、無作為化試験
解析結果:LH上昇の用量反応性の解析にはCochran-Armitage検定(並び替えによる正確な方法)を使用し、検証的に解析した。胎児心拍陽性妊娠率の解析には治療群と施設を分類変数としてロジスティック回帰分析を行った。副次評価パラメータの採卵数及び良好胚については、治療群と施設を分類変数として分散分析を行い、さらに各群間で対比較を行った。全ての統計解析の有意水準は5%(両側)とした。
申請時評価資料
【用法及び用量】
原則として卵胞刺激ホルモン製剤投与の6日目から開始し、ガニレリクスとして0.25mgを1日1回皮下に連日投与する。